NUBEQA-达洛鲁胺片,薄膜包衣的
拜耳医药保健制药公司。
----------
| 处方信息要点 这些重点内容并不包括安全有效地使用NUBEQA所需的所有信息。查看NUBEQA的完整处方信息。 NUBEQA(darolutamide)片剂,口服使用 美国最初批准:2019年 |
|---|
适应症和用途
NUBEQA是一种雄激素受体抑制剂,可用于治疗非转移性去势抵抗性前列腺癌患者。(1)
剂量和给药
NUBEQA 600毫克(两片300毫克片剂)每天口服两次。吞咽片整个。随便吃NUBEQA。(2.1) 患者还应该同时接受促性腺激素释放激素(GnRH)类似物,或者应该进行双侧睾丸切除术。(2.3)
剂量形式和强度
片剂:300毫克(3)
禁忌症
没有。(4)
警告和注意事项
胚胎-胎儿毒性:NUBEQA会造成胎儿伤害和失去妊娠。建议男性与有生殖潜力的女性伴侣一起使用有效的避孕方法。(5.1,8.1,8.3)
不良反应
最常见的不良反应(≥2%)是疲劳,四肢疼痛和皮疹。(6)
要报告可疑的不良反应,请致电1-888-842-2937与拜耳医药保健公司联系,或致电1-800-FDA-1088与FDA联系或访问www.fda.gov/medwatch。
药物相互作用
•P-gp与强或中度CYP3A诱导剂合用:避免同时使用。(7.1)
•P-gp和强效CYP3A抑制剂合用:更加频繁地监测患者的NUBEQA不良反应。(7.1)
•BCRP底物:尽可能避免同时使用作为BCRP底物的药物。如果一起使用,应更频繁地监测患者的不良反应,并考虑降低BCRP底物药物的剂量。(7.2)。
在特定人口中使用
严重肾功能不全(不进行血液透析):建议剂量为每天两次300 mg。(8.6)
中度肝功能不全:建议剂量为每天两次300 mg。(8.7)
有关患者咨询信息和FDA批准的患者标签,请参见17。
完整的处方信息:目录*
1适应症和用途
2剂量和给药
2.1推荐剂量
2.2剂量修改
2.3严重肾功能不全患者的推荐剂量
2.4中度肝功能不全患者的推荐剂量
3剂型和强度
4禁忌症
5警告和注意事项
5.1胚胎-胎儿毒性
6不良反应
7药物相互作用
7.1其他药物对NUBEQA的影响
7.2 NUBEQA对其他药物的影响
8在特定人群中的使用
8.1怀孕
8.2哺乳
8.3生殖潜力的雌雄
未列出全部处方信息中的节或小节。
完整的处方信息
1适应症和用途
NUBEQA被指定用于治疗非转移性去势抵抗性前列腺癌(nmCRPC)的患者。
2剂量和给药
2.1推荐剂量
NUBEQA的推荐剂量为600毫克(两片300毫克薄膜包衣片剂),每天两次,相当于每日总剂量1200毫克。随食物一起吞下的药片[请参见临床药理学(12.3)]。
接受NUBEQA的患者还应同时接受促性腺激素释放激素(GnRH)类似物,或者应该进行双侧睾丸切除术。
建议患者在记住下一个计划的剂量之前尽快服用任何错过的剂量,并且不要同时服用两剂以弥补错过的剂量。
2.2剂量修改
如果患者发生大于或等于3级毒性或无法忍受的不良反应,则每天两次停药或减至300 mg,直至症状改善。然后可以每天两次以600mg的剂量重新开始治疗。
不建议每天两次降低剂量至300 mg以下。
2.3严重肾功能不全患者的推荐剂量
对于没有进行血液透析的严重肾功能不全(eGFR 15–29 mL / min / 1.73 m 2)的患者,NUBEQA的推荐剂量为每天两次300 mg [请参见在特定人群中使用(8.6)和临床药理学(12.3)]。
2.4中度肝功能不全患者的推荐剂量
对于中度肝功能不全(Child-Pugh B级)的患者,NUBEQA的推荐剂量为每天两次300 mg [请参见在特定人群中使用(8.7)和临床药理学(12.3)]。
3剂型和强度
片剂(300毫克):白色至灰白色椭圆形薄膜衣片,一侧标有“ 300”,另一侧标有“ Bayer”。
4禁忌症
没有。
5警告和注意事项
5.1胚胎-胎儿毒性
NUBEQA的安全性和有效性尚未在女性中确定。根据其作用机理,NUBEQA对孕妇使用时可引起胎儿伤害和妊娠流失[见临床药理学(12.1)]。
提醒男性生殖潜在的女性伴侣到NUBEQA的最后一次给药后治疗期间和1周使用有效的避孕[见特殊人群中使用(8.1,8.3)]。
6不良反应
由于临床试验是在广泛不同的条件下进行的,因此无法将在某种药物的临床试验中观察到的不良反应率直接与另一种药物的临床试验中观察到的不良反应率进行比较,并且可能无法反映实际中观察到的不良反应率。
ARAMIS是一项随机(2:1),双盲,安慰剂对照,多中心临床研究,纳入了非转移性,去势抵抗性前列腺癌(nmCRPC)的患者。在这项研究中,患者每天两次接受600 mg NUBEQA或安慰剂。ARAMIS研究中的所有患者均接受了促性腺激素释放激素(GnRH)类似物或双侧睾丸切除术。接受NUBEQA的患者的中位暴露时间为14.8个月(范围:0至44.3个月)。
总体而言,接受NUBEQA的患者中有25%发生严重不良反应,接受安慰剂的患者中有20%发生严重不良反应。接受NUBEQA的患者中≥1%的严重不良反应包括尿retention留,肺炎和血尿。总共3.9%的接受NUBEQA的患者和3.2%的接受安慰剂的患者死于不良反应,包括死亡(0.4%),心力衰竭(0.3%),心脏骤停(0.2%),总体身体健康恶化(0.2%),和NUBEQA的肺栓塞(0.2%)。
接受NUBEQA或安慰剂的患者中有9%因不良反应而永久停药。接受NUBEQA的患者中需要永久停药的最常见不良反应包括心力衰竭(0.4%)和死亡(0.4%)。
NUBEQA治疗的患者中有13%因不良反应导致剂量中断。接受NUBEQA的患者中最常见的需要中断剂量的不良反应包括高血压(0.6%),腹泻(0.5%)和肺炎(0.5%)。
NUBEQA治疗的患者中有6%因不良反应而减少剂量。使用NUBEQA治疗的患者中最常见的需要减少剂量的不良反应包括疲劳(0.7%),高血压(0.3%)和恶心(0.3%)。
表1显示了NUBEQA组报告的ARAMIS中的不良反应,与安慰剂相比,绝对频率增加了≥2%。表2显示了与NUBEQA治疗相关的实验室测试异常,并且在ARAMIS研究中,与安慰剂治疗的患者相比,NUBEQA治疗的患者报告的频率更高。
| 表1:ARAMIS中的不良反应 | ||||
|---|---|---|---|---|
| 不良反应* | 努贝卡 (n = 954) | 安慰剂 (n = 554) | ||
| 所有级 (%) | 级> 3 (%) | 所有级 (%) | 级> 3(%) | |
| 疲劳† | 16 | 0.6 | 11 | 1.1 |
| 四肢疼痛 | 6 | 0 | 3 | 0.2 |
| 皮疹 | 3 | 0.1 | 1个 | 0 |
*不良事件通用术语标准(CTCAE)版本4.03
†包括疲劳和乏力
此外,用NUBEQA治疗的患者中有2%或更多发生的临床上显着的不良反应包括缺血性心脏病(4.0%vs安慰剂3.4%)和心力衰竭(2.1%vs 0.9%安慰剂)。
| 表2:ARAMIS中的实验室测试异常 | |||||
| 实验室异常 | NUBEQA (N = 954)* | 安慰剂 (N = 554)* | |||
| 所有级† % | 3-4级† % | 所有级† % | 3-4级† % | ||
| 中性粒细胞计数下降 | 20 | 4 | 9 | 0.6 | |
| AST增加 | 23 | 0.5 | 14 | 0.2 | |
| 胆红素升高 | 16 | 0.1 | 7 | 0 | |
*用于计算比率的分母根据具有基线值和至少一个治疗后值的患者数量而变化。
†不良事件通用术语标准(CTCAE)版本4.03。
7药物相互作用
7.1其他药物对NUBEQA的影响
结合P-gp和强或中度CYP3A4诱导剂
NUBEQA与P-gp和强或中度CYP3A4诱导剂联合使用会降低darolutamide的暴露量,这可能会降低NUBEQA的活性[见临床药理学(12.3)]。避免将NUBEQA与P-gp和强或中度CYP3A4诱导剂同时使用。
P-gp和强效CYP3A4抑制剂的组合
NUBEQA与P-gp和强效CYP3A4抑制剂联合使用会增加darolutamide的暴露[见临床药理学(12.3)],这可能会增加NUBEQA不良反应的风险。更加频繁地监测患者的NUBEQA不良反应,并根据需要修改NUBEQA剂量[参见剂量和用法(2.2)]。
7.2 NUBEQA对其他药物的影响
乳腺癌抗性蛋白(BCRP)底物
NUBEQA是BCRP转运蛋白的抑制剂。NUBEQA的同时使用会增加BCRP底物的AUC和C max [参见临床药理学(12.3)],这可能会增加BCRP底物相关毒性的风险。
尽可能避免与BCRP底物同时使用。如果一起使用,应更频繁地监测患者的不良反应,并考虑降低BCRP底物药物的剂量。与NUBEQA一起使用时,请查阅BCRP基材的认可产品标签。
8在特定人群中的使用
8.1怀孕
风险摘要
NUBEQA的安全性和有效性尚未在女性中确定。根据其作用机理,NUBEQA可以引起胎儿伤害和妊娠流失[见临床药理学(12.1)]。达洛鲁胺未进行动物胚胎-胎儿发育毒理学研究。没有关于孕妇使用NUBEQA的人类数据。
8.2哺乳
风险摘要
NUBEQA的安全性和有效性尚未在女性中确定。没有关于母乳中存在达洛鲁胺或其代谢产物,对母乳喂养的孩子的影响或对牛奶生产的影响的数据。
8.3生殖潜力的雌雄
避孕
雄性
根据作用机理,建议具有生殖潜能的女性伴侣的男性患者在治疗期间和最后一次服用NUBEQA后1周内使用有效的避孕药[见在特定人群中使用(8.1)]。
不孕症
雄性
根据动物研究,NUBEQA可能会损害具有生殖潜力的男性的生育能力[请参阅非临床毒理学(13.1)]。
8.4小儿使用
尚未确定NUBEQA在儿科患者中的安全性和有效性。
8.5老年用途
在954名ARAMIS中接受NUBEQA治疗的患者中,有88%的患者年龄在65岁以上,有49%的患者年龄在75岁以上。在这些患者和年轻患者之间未观察到安全性或疗效的总体差异。
8.6肾功能不全
严重肾功能不全(eGFR 15–29 mL / min / 1.73 m 2)且未接受血液透析的患者暴露于NUBEQA的风险较高,建议降低剂量[请参见剂量和用法(2.3)和临床药理学(12.3) ]。轻度或中度肾功能不全(eGFR 30-89 mL / min / 1.73 m 2)的患者无需降低剂量。终末期肾脏疾病(eGFR≤15mL / min / 1.73 m 2)对达洛鲁胺药代动力学的影响尚不清楚。
8.7肝功能不全
中度肝功能不全(Child-Pugh B级)的患者对NUBEQA的暴露较高,建议降低剂量[参见剂量和用法(2.4)和临床药理学(12.3)]。轻度肝功能不全患者无需降低剂量。尚无严重肝功能损害(Child-Pugh C)对他洛鲁胺药代动力学的影响。
10过量
尚无已知的过量服用达洛鲁胺的特定解毒剂。临床研究的NUBEQA最高剂量为每天两次900毫克,相当于每日总剂量1800毫克。在该剂量下未观察到剂量限制性毒性。
考虑到饱和吸收和缺乏急性毒性的证据,在肝和肾功能正常的患者中摄入达洛鲁胺的剂量高于推荐剂量不会导致全身毒性[见临床药理学(12.3)]。
如果严重肾功能不全或中度肝功能不全的患者摄入高于推荐剂量的药物,如果怀疑存在毒性,请中断NUBEQA治疗并采取一般支持措施,直到临床毒性降低或解决。如果没有毒性反应,可以按计划继续下一次剂量继续NUBEQA治疗。
11说明
NUBEQA是一种雄激素受体抑制剂。化学名称为N-{(2S)-1- [3-(3-氯-4-氰基苯基)-1H-吡唑-1-基]丙烷-2-基} -5-(1-羟乙基)-1H -吡唑-3-羧酰胺。
分子量为398.85,分子式为C 19 H 19 Cl N 6 O 2。结构式为:
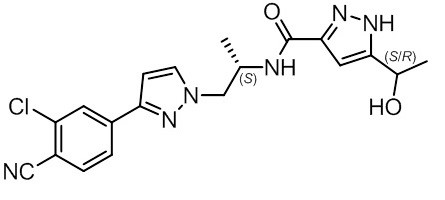
达洛鲁胺是一种旋光性化合物,具有特定的旋转值[α] 20 D = 72.2 o * mL /(dm * g),为白色至灰白色或淡黄色白色结晶性粉末,可溶于四氢呋喃,但实际上不溶于水性介质。Darolutamide的pKa为11.75。
NUBEQA(darolutamide)以薄膜包衣片剂形式提供,其中含有300 mg的darolutamide口服。片剂的非活性成分为:磷酸氢钙,交联羧甲基纤维素钠,乳糖一水合物,硬脂酸镁,聚维酮K 30,羟丙甲纤维素15 cP,聚乙二醇3350和二氧化钛。
12临床药理学
12.1行动机制
Darolutamide是一种雄激素受体(AR)抑制剂。达洛鲁胺竞争性地抑制雄激素结合,AR核易位和AR介导的转录。主要代谢物,酮-darolutamide,显示出与达洛鲁胺相似的体外活性。此外,达洛鲁胺在体外起孕激素受体(PR)拮抗剂的作用(与AR相比,活性约为1%)。Darolutamide降低前列腺癌细胞增殖的体外和肿瘤体积在小鼠异种移植前列腺癌模型。
12.2药效学
每天两次600 mg的Darolutamide暴露导致PSA平均比基线降低90%以上。
心脏电生理学
在ARAMIS研究中,在500名患者的亚组中评估了他鲁鲁胺(600 mg每天两次)对QTc间隔的影响。没有检测到QTc的大的平均增加(即> 20 ms)。
12.3药代动力学
每天两次给药600 mg后,达洛鲁胺稳态状态的平均血浆峰值浓度(Cmax)为4.79 mg / L(30.9%),血浆浓度-时间曲线下的面积为0到12小时(AUC)12h)为52.82 h•µg / mL(33.9%)。重复服用食物后2至5天达到稳态,积累约2倍。
在100至700mg(0.17至1.17倍于批准的推荐剂量)的剂量范围内,达洛鲁胺和活性代谢物酮-darolutamide 的暴露量(C max和AUC 12)几乎与剂量成比例。每天两次900毫克(批准的推荐剂量的1.5倍)未观察到darolutamide暴露量进一步增加。
吸收性
在单次口服600 mg后约4小时,达到Darolutamide C max。
在禁食条件下口服含300毫克darolutamide的NUBEQA片剂后,绝对生物利用度约为30%。
食物效应
与食物一起服用时,他洛鲁胺的生物利用度增加了2.0到2.5倍。活性代谢物酮-darolutamide的暴露量也有类似的增加。
分配
静脉给药后,达洛鲁胺的表观分布体积为119L。
达洛鲁胺的蛋白质结合率为92%,活性代谢物酮-darolutamide的蛋白质结合率为99.8%。血清白蛋白是达洛鲁胺和酮-darolutamide的主要结合蛋白。
消除
达洛鲁胺和酮-darolutamide的有效半衰期在患者中约为20小时。静脉内给药后,他洛鲁胺的清除率(%CV)为116 mL / min(39.7%)。
代谢
Darolutamide主要由CYP3A4以及UGT1A9和UGT1A1代谢。血浆中酮基-darolutamide的总暴露量比darolutamide高1.7倍。
排泄
在单次放射性标记剂量的口服溶液后,总共有63.4%的与达洛鲁胺相关的物质从尿中排泄(大约7%不变),并在粪便中排出32.4%(大约30%不变)。给药后7天内恢复了95%以上的剂量。
特定人群
在nmCRPC患者中,根据年龄(48-95岁),种族(白人,日本人,非日本亚裔,黑人或非裔美国人),轻度至中度肾功能不全(eGFR 30),未观察到达洛鲁胺药代动力学的临床显着差异–89 mL / min / 1.73m 2)或轻度肝功能不全。
在患有严重肾功能不全(eGFR15–29 mL / min / 1.73 m 2)且未接受透析或中度肝功能不全(Child-Pugh B级)的非癌症受试者中,NUBEQA暴露增加了约2.5倍和1.9倍,分别与健康受试者进行比较。
尚未研究终末期肾脏疾病(eGFR <15 mL / min/ 1.73 m 2)或严重肝功能不全(Child-Pugh C)对他洛鲁胺药代动力学的影响。
药物相互作用研究
临床研究
结合P-gp和强CYP3A4诱导剂
利福平(P-gp和强效CYP3A4诱导剂的组合)的同时使用会使平均darolutamide AUC 0-72降低72%,Cmax降低52%。预计中度CYP3A4诱导剂的darolutamide暴露减少量在36%– 58%范围内。
P-gp和强效CYP3A4抑制剂的组合
伊曲康唑(较强的组合CYP3A4及P-gp抑制剂)增加平均darolutamide AUC 0-72由1.7-和C 最大值 1.4倍。
CYP3A4底物
并用darolutamide会使咪达唑仑(CYP3A4底物)的平均AUC和C max分别降低29%和32%。当与达洛鲁胺同时使用时,在咪达唑仑的药代动力学上没有观察到临床上的显着差异。
BCRP基材
伴随使用达洛鲁胺会使瑞舒伐他汀(BCRP底物)的平均AUC和C max增加约5倍。
P-gp基板
与达洛鲁胺同时使用时,达比加群(P-gp底物)的药代动力学没有临床上的显着差异。
体外研究
在体外,达洛鲁胺抑制OATP1B1和OATP1B3。在临床相关浓度下,达洛鲁胺不会抑制主要的CYP酶(CYP1A2、2A6、2B6、2C8、2C9、2C19、2D6、2E1和3A4)或转运蛋白(MRP2,BSEP,OAT,OCT,MATE,OATP2B1和NTCP) 。
13毒理学
13.1致癌,诱变,生育力受损
尚未进行评估达洛鲁胺致癌潜能的长期动物研究。
在人外周血淋巴细胞的体外染色体畸变分析中,达洛鲁胺具有致死性。达洛鲁胺在细菌反向突变(Ames)分析中不诱导突变,并且在大鼠肝脏和十二指肠的体内联合骨髓微核试验和Comet试验中没有遗传毒性。
达洛鲁胺尚未在动物中进行生育力研究。在雄性大鼠(长达26周)和狗(长达39周)的重复剂量毒性研究中,以≥100 mg的剂量观察到睾丸的管状扩张,精子减少和精囊,睾丸,前列腺和附睾的萎缩。 / kg /天的老鼠(基于AUC的人体暴露量的0.6倍)和≥50 mg / kg /天的狗(约为基于AUC的人类暴露量的1倍)。
14临床研究
ARAMIS(NCT02200614)是一项多中心,双盲,安慰剂对照的临床试验,用于1509例非转移性去势抵抗性前列腺癌且前列腺特异性抗原加倍时间(PSADT)≤10个月的患者。通过PSADT进行随机分组,并在研究开始时采用骨靶向治疗。骨盆淋巴结在主动脉分叉以下短轴小于2 cm的患者被允许进入研究。没有排除有癫痫病史的患者。转移是否存在通过盲独立中央评价(BICR)进行评估。PSA结果不盲目,不用于治疗中止。
患者按2:1的比例随机分配,每天口服两次600毫克darolutamide(n = 955)或匹配的安慰剂(n = 554)。继续治疗直至通过CT,MRI,BICR进行99m Tc骨扫描评估放射影像学疾病进展,毒性不可接受或停药。所有患者同时接受促性腺激素释放激素(GnRH)类似物或双侧睾丸切除术。
以下两组患者的人口统计学特征和疾病特征得到了平衡。中位年龄为74岁(范围48-95),9%的患者年龄在85岁以上。种族分布是79%的白人,13%的亚裔和3%的黑人。大多数患者(73%)在诊断时的格里森评分为7或更高。PSADT中位数为4.5个月。两个治疗组中有42%的患者曾接受过前列腺手术或放疗。在研究开始时,有11%的患者骨盆淋巴结肿大小于2 cm。BICR回顾性鉴定了百分之六的患者在基线时有转移。73%的患者接受过抗雄激素(比卡鲁胺或氟他胺)治疗。在研究开始时,所有患者的东部合作肿瘤小组表现状态(ECOG PS)评分均为0或1。NUBEQA组招募了12例有癫痫病史的患者。基线时,47%的患者在简短疼痛清单-简短表格(每日最严重疼痛项目的7天日记平均值)上报告没有疼痛。
主要功效终点为无转移生存期(MFS),定义为从随机化到最后一次可评估的扫描后33周内BICR确认的远处转移或任何原因死亡的第一个证据的时间,以先到者为准。远处转移定义为新的骨或软组织病变或主动脉分叉处淋巴结肿大。总生存期(OS)和疼痛进展时间是其他功效终点。
表3和图1总结了来自ARAMIS的MFS的疗效结果。与安慰剂相比,使用NUBEQA治疗可导致MFS的统计显着改善。PSADT(≤6个月或> 6个月)或先前使用骨靶向药物(是或否)的患者亚组的MFS结果一致。在进行最终MFS分析时,操作系统数据尚未成熟(占所需事件数量的57%)。仅有局部区域进展的患者占总数的6%。
| 表3:ARAMIS研究的疗效结果 | ||
|---|---|---|
| 努贝卡 (N = 955) | 安慰剂 (N = 554) | |
| 无转移生存 | ||
| 活动数量(%) | 221(23) | 216(39) |
| 中位数,月(95%CI)* | 40.4(34.3,NR †) | 18.4(15.5,22.3) |
| 危害比(95%CI)‡ | 0.41(0.34,0.50) | |
| P值§ | <0.0001 | |
*根据Kaplan-Meier估计
†NR:未达到
‡危害比基于PSADT分层的Cox回归模型(以治疗为唯一协变量)(≤6个月vs.> 6个月)和采用破骨细胞靶向疗法(是vs否)。危险比<1有利于NUBEQA
§P值基于PSADT的分层对数秩检验(≤6个月vs.> 6个月)和使用破骨细胞靶向疗法(是vs.否)

图1:Kaplan Meier曲线无转移生存
MFS结果得到了疼痛进展时间延迟的支持,该时间被定义为与安慰剂相比,NUBEQA治疗的患者在简短疼痛量表-简短表格或阿片类药物起始时的疼痛评分基线降低了至少2分。据报道,研究中所有患者中有28%出现疼痛进展。
16供应/存储和处理方式
16.1供应方式
NUBEQA(darolutamide)300毫克薄膜衣片为白色至类白色椭圆形药片,一侧标有“ 300”,另一侧标有“ BAYER”。NUBEQA 300毫克片剂有120片装。
NDC 50419-395-01
16.2储存和处理
存放在20°C至25°C(68°F至77°F); 允许在15°C至30°C(59°F至86°F)之间的偏移[请参阅USP控制的室温]。
首次打开后,请保持瓶子密闭。
17患者咨询信息
剂量和给药
告知接受促性腺激素释放激素(GnRH)类似疗法的患者,他们需要在使用NUBEQA的治疗过程中维持这种治疗。
指导患者服用两片药片(每天两次)。NUBEQA应该与食物一起服用。每片都应全部吞下。
告知患者如果错过了NUBEQA的每日剂量,请在记住下一个预定剂量之前尽快服用任何错过的剂量,并且不要同时服用两次以弥补错过的剂量[请参阅剂量和剂量管理(2.1)]。
胚胎-胎儿毒性
告知患者NUBEQA可能对发育中的胎儿有害并可能导致妊娠流失[请参阅在特定人群中使用(8.1)]。
建议男性患者繁殖潜力的女性伴侣NUBEQA的最后一次给药后治疗期间和1周使用有效的避孕[见警告和注意事项(5.1),并使用在特殊人群中(8.1,8.3)]。
不孕症
告知男性患者NUBEQA可能会损害生育能力[请参见在特定人群中使用(8.3)]。
制造商: Orion Corporation,Orion Pharma,FI-02101 Espoo,芬兰
生产厂商:美国新泽西州惠潘尼,拜耳医药保健制药公司
| 患者信息 NUBEQA™( NO͞O-bə-kə) (darolutamide) 片剂 | |
|---|---|
| 什么是NUBEQA? NUBEQA是一种处方药,用于治疗尚未扩散到身体其他部位并且不再对降低睾丸激素的药物或手术疗法产生反应的前列腺癌男性。 NUBEQA在女性中是否安全有效尚不明确。 尚不清楚NUBEQA在儿童中是否安全有效。 | |
| 在服用NUBEQA之前,请告知您的医疗保健提供者您的所有医疗状况,包括是否: • 有肾脏或肝脏问题 •正在怀孕或打算怀孕。NUBEQA可能会对未出生的婴儿造成伤害并失去怀孕(流产)。 •有一个可能怀孕的伴侣。男性或女性伴侣可能会怀孕,应在治疗期间和末次服用NUBEQA后1周内使用有效的节育(避孕)方法。与您的医疗保健提供者讨论节育方法。 •正在母乳喂养或计划母乳喂养。不知道NUBEQA是否会进入母乳。 告诉您的医疗保健提供者您所服用的所有药物,包括处方药和非处方药,维生素和草药补品。NUBEQA可能会影响其他药物的工作方式,而其他药物可能会影响NUBEQA的工作方式。 在与开具NUBEQA的医疗服务提供者交谈之前,您不应该开始或停止任何药物。 知道你吃的药。随身携带一份清单,以便在您购买新药时向医疗保健提供者和药剂师显示。 | |
| 我应该如何服用NUBEQA? •完全按照您的医疗保健提供者告诉您的那样服用NUBEQA。 •您的医疗保健提供者可能会根据需要更改您的剂量。 •每天2次服用您指定剂量的NUBEQA。 •吞服整个NUBEQA片剂。 •如果您正在接受促性腺激素释放激素(GnRH)类似疗法,则在进行NUBEQA治疗期间应继续进行这种治疗,除非您已进行过手术以降低体内睾丸激素的量(手术去势)。 •如果您错过一剂NUBEQA,请记得在下次预定剂量前尽快服用您的处方剂量。不要一起服用2剂来弥补错过的剂量。 | |
| NUBEQA可能有哪些副作用? NUBEQA最常见的副作用包括: | |
| •比平常更累 •手臂,腿,手或足部疼痛 •皮疹 •白细胞减少(中性粒细胞减少症) •肝功能检查变化 | |
| NUBEQA可能会导致男性的生育问题,这可能会影响生育孩子的能力。如果您担心生育问题,请与您的医疗保健提供者联系。 这些并不是NUBEQA的所有可能的副作用。 致电您的医疗保健提供者以获取有关副作用的医疗建议。您可以通过1-800-FDA-1088向FDA报告副作用。 | |
| 我应该如何存储NUBEQA? •将NUBEQA存放在68°F至77°F(20°C至25°C)之间的室温下。 •首次打开后,请保持瓶子密闭。 将NUBEQA和所有药物放在儿童接触不到的地方。 | |
| 有关安全有效使用NUBEQA的一般信息。 有时出于患者信息手册中列出的目的以外的目的开出药物。请勿在未指定条件的情况下使用NUBEQA。即使他人有与您相同的症状,也不要将NUBEQA给予他人。可能会伤害他们。 您可以向您的医疗保健提供者或药剂师询问为保健专业人员编写的有关NUBEQA的信息。 | |
| NUBEQA中的成分是什么? 活性成分: 达洛鲁胺 非 活性成分: 磷酸氢钙,交联羧甲基纤维素钠,乳糖一水合物,硬脂酸镁,聚维酮K 30,羟丙甲纤维素15 cP,聚乙二醇3350和二氧化钛。 制造商: Orion Corporation,Orion Pharma,FI-02101 Espoo,芬兰 生产厂商:美国新泽西州惠潘尼,拜耳医药保健制药公司 分级为4 +©2019 Bayer HealthCare Pharmaceuticals Inc. 有关更多信息,请致电1-888-842-2937,致电Bayer的Bayer HealthCare Pharmaceuticals Inc.或访问www.NUBEQA-us.com | |

