批准日期:4月28,2017;公司:Radius Health,Inc.
为治疗:骨质疏松症
处方资料重点
这些重点不包括安全和有效使用TYMLOS需所有资料。请参阅TYMLOS IMFINZI整处方资料。
注射用TYMLOS™(abaloparatide),为皮下使用
美国初次批准:2017

适应证和用途
TYMLOS是一种人甲状旁腺激素相关肽[PTHrP(1-34)]类似物适用为有骨质疏松症绝经后妇女的治疗。(1)
剂量和给药方法
● 推荐剂量为80 µg皮下每天1次,患者应接受补充钙和维生素D如不适宜每天膳食摄取。(2.1)
● 作为一个皮下注射至腹部的脐周围给药。(2 2)
● 在发生体位性低血压症状的情况初始地在患者可坐或躺下处给药。(2.2,5.2)
剂型和规格
注射用:3120 µg/1.56 mL(2000 µg/mL)在一个单次-患者-使用预充填笔。预装笔输送30次每天剂量的80 µg abaloparatide在40 µL的无菌,清晰,无色溶液。(3)
禁忌证
无。(4)
警告和注意事项
●体位性低血压:如给药后症状发生指导患者坐或躺下。(5.2)
●高钙血症:在患者有预先存在高钙血症和已知有潜在高钙血症疾病患者,例如原发性甲状旁腺功能亢进避免使用。(5.3)
●高钙尿症和尿石病:监视尿钙如预先存在高钙尿症或怀疑活动性尿石病。(5.4)
不良反应
最常见不良反应(发生率 ≥2%)为高钙尿症,眩晕,恶心,头痛,心悸,疲乏,上腹痛和眩晕。(6.1)
报告怀疑不良反应,联系Radius Health,Inc.电话1-855-672-3487或FDA电话1-800-FDA-1088或www.fda.gov/medwatch。
完整处方资料

1 适应证和用途
TYMLOS是适用为处于骨折高风险有骨质疏松症绝经后妇女的治疗被定义为骨质疏松症骨折,对骨折多风险因子病史,或患者曽失败或对其他可得到的骨质疏松症治疗是不能耐受。在有骨质疏松症绝经后妇女,TYMLOS减低脊椎骨折和非脊椎骨折的风险[见临床研究(14)]。
使用的限制
因为不知道啮齿类动物骨肉瘤发现与人的相关性,建议患者的生命期期间不累计使用TYMLOS和甲状旁腺激素类似物(如,特立帕肽)共多于2年[见警告和注意事项(5.1)]。
2 剂量和给药方法
2.1 推荐剂量
● TYMLOS推荐剂量是80 µg皮下地每天1次.
● 不推荐TYMLOS和甲状旁腺激素类似物(如,特立帕肽)患者的生命期的累计使用共超过2年 [见警告和注意事项(5.1)]。
●患者应接受补充性钙和维生素D如每天膳食摄取是不适当。.
2.2 给药指导
● 给予TYMLOS作为一个皮下注射至腹部脐周围区。旋转注射部位每天和给予在约相同时间每天。不要静脉地或肌肉内地给予.
●在发生体位性低症状的情况中,如必要时在患者能坐下或躺下处给予头几次剂量[见警告和注意事项(5.2)和不良反应(6.1)]。
●TYMLOS是一个清晰和无色溶液。给药前视力观察TYMLOS对颗粒物质和变色。如出现实体颗粒或如溶液是云雾状或有色不要使用。
●对患者和护理人员对适当使用TYMLOS笔提供适当训练和指导。
3 剂型和规格
注射液:3120 µg/1.56 mL(2000 µg/mL)在一个一次性-患者-使用预充填笔,预充填笔输送30剂量的TYMLOS,每支含在40 µL的无菌,清晰,无色溶液80 µg的abaloparatide。
4 禁忌证
无。
5 警告和注意事项
5.1骨肉瘤的风险
Abaloparatide致一个剂量依赖增加在骨肉瘤的发生率在雄性和雌性大鼠皮下给药在暴露4至28倍人暴露在临床剂量80 µg后[见非临床毒理学(13.1)]。不知道在人中TYMLOS是否将致骨肉瘤。
在患者处于骨肉瘤的风险增加包括患者有骨Paget氏病或碱性磷酸酶的不能接受解释升高,开放性骨垢板,骨转移或骨额性病,易发生骨肉瘤遗传疾患,或涉及骨植入辐射治疗建议不使用TYMLOS。
不推荐累计使用TYMLOS和甲状旁腺激素类似物(如,特立帕肽)共超过患者的生命期2年。
5.2 体位性低血压
用TYMLOS可能发生体位性低血压,典型地注射的4小时内。伴随症状可能包括眩晕,心悸,心动过速或恶心,和通过患者躺下可能解决。如必要时对头几剂量,TYMLOS应被给予在患者能坐下或躺下处[见不良反应(6.1)]。
5.3 高钙血症
TYMLOS可能致高钙血症。在有预先存在高钙血症患者或in患者有潜在高钙血症疾病建议不使用TYMLOS,例如原发性甲状旁腺功能亢进,因为加重高钙血症的可能性[见不良反应(6.1)]。
5.4 高钙尿症和尿石病
TYMLOS可能致高钙尿症。不知道在有活动性或一个尿石病病史患者,TYMLOS是否可能加重尿石病。如怀疑活动性尿石病或预先存在高钙尿症,应考虑尿钙排泄的测量[见不良反应(6.1)]。
6 不良反应
在其他节更详细描述以下不良反应:
●体位性低血压[见警告和注意事项(5.2)]
●高钙血症[见警告和注意事项(5.3)]
●高钙尿症和尿石病[见警告和注意事项(5.4)]
6.1 临床试验经验
因为临床试验是在广泛不同情况下进行的,临床试验观察到不良反应率不能与另一种药临床试验发生率直接比较而且可能不反映实践中观察到的发生率。
有骨质疏松症绝经后妇女
在一项随机化,多中心,双盲,安慰剂-对照临床试验在有骨质疏松症绝经后妇女评价TYMLOS的安全性,患者年龄49至86岁(均数年龄69岁)患者被随机化至接受80 µg的TYMLOS(N = 824)或安慰剂(N = 821),给予皮下地每天1次共18个月[见临床研究(14)]。
在这项研究中,在TYMLOS组所有-原因死亡率的发生率为0.4%和在安慰剂组0.6%。在TYMLOS组严重不良事件的发生率为10%和在安慰剂组11%。在TYMLOS组由于不良事件终止研究药物患者的百分率为10%和在安慰剂组6%。在TYMLOS组最常见不良反应导致研究药物终止为恶心(2%),眩晕(1%),头痛(1%),和心悸(1%)。
表1显示在试验中最常见不良反应。这些不良反应在基线时一般不存在,用TYMLOS比用安慰剂更常见发生,和用TYMLOS治疗患者发生至少2%。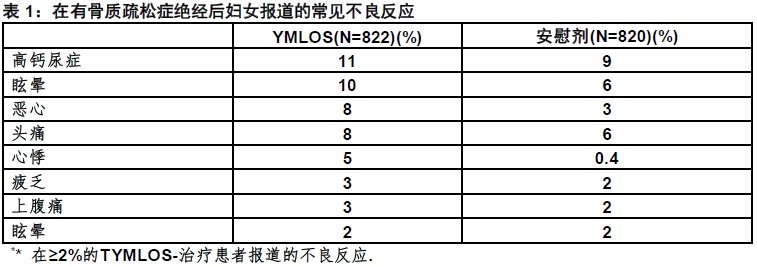
体位性低血压
在有绝经后骨质疏松症妇女的临床试验中,在TYMLOS组直立位血压下降 ≥20 mmHg收缩压或≥10 mmHg 舒张压的发生率在首次注射后1小时为4%和在安慰剂组为3%。在以后时间点在治疗组间的发生率是一般地相似。接受TYMLOS中1%患者报道体位性低血压的不良反应和接受安慰剂患者为0.5%。TYMLOS-治疗患者(10%)报道眩晕比安慰剂(6%)更多[见警告和注意事项(5.2)]。
心动过速
在有绝经后骨质疏松症妇女,在2%接受TYMLOS患者报道心动过速的不良反应,包括窦性心动过速和在安慰剂组1%患者。在5/13患者接受TYMLOS经受心动过速,症状发生在给药的1小时内。TYMLOS曽伴随有一个剂量依赖心率增加,它发生在注射后15分钟内和在约6个小时中解决[见临床药理学(12.2)]。
注射部位反应
试验的头一个月期间,每天在注射后一个小时评价注射部位反应。TYMLOS比安慰剂有一个注射部位发红较高的发生率(58%相比28%),水肿(10%相比3%)和疼痛(9%相比7%)。严重发红,严重水肿,和严重疼痛被报道在2.9%,0.4%,和0.4%的TYMLOS-治疗患者中。.
实验室异常
高钙血症
在有绝经后骨质疏松症妇女的临床试验中,TYMLOS致在血清中钙浓度增高[见警告和注意事项(5.3)]。高钙血症的发生率,被定义为白蛋白校正血清钙≥10.7 mg/dL在TYMLOS-治疗患者在任何随访注射后4小时为3%而用安慰剂为0.1%。在两组中给药前血清钙是相似于基线。有2例(0.2%)TYMLOS-治疗患者和无安慰剂-治疗患者由于高钙血症从研究终止。在有轻度或中度肾受损患者(4%)与有正常肾功能患者(1%)用 TYMLOS钙血症的发生率是较高.
在血清尿酸增加
TYMLOS增加血清尿酸浓度。在绝经后骨质疏松症试验中,在TYMLOS组25%患者有正常基线尿酸浓度患者,和在安慰剂组6%患者有至少一次基线后浓度高于正常范围。在TYMLOS-治疗患者观察到的高尿酸血症不伴随一个增加不良反应的痛风或关节痛超过用安慰剂观察到。
高钙尿症和尿石病
在有绝经后骨质疏松症妇女的临床试验中,尿钙肌酐比值 >400 mg/g的总体发生率用TYMLOS是较高于用安慰剂(分别20%相比15%)。2.1%的TYMLOS-治疗患者报道尿石症而安慰剂-治疗患者为1.7%。
在有骨质疏松症绝经后妇女来自延伸研究不良反应
用TYMLOS或安慰剂治疗18个月后,1139例妇女转换治疗用阿仑膦酸钠[alendronate]70 mg 口服给予每周1次。阿仑膦酸钠治疗期间不良事件的发生率是与患者以前安慰剂或TYMLOS治疗相似[见临床研究(14)]。
6.2 免疫原性
如同所有治疗性蛋白,有对免疫原性潜能。抗体形成的检测是高度依赖于分析的灵敏度和特异性。此外,在一项分析中抗体观测阳性的观察发生率(包括中和抗体)可能受几种因子影响包括分析方法学,样品处置,采样时机,同时药物,和所患疾病。因为这些理由,在下面研究中描述对TYMLOS抗体的发生率与其他研究或对其他产品中抗体的的发生率比较可能是误导。
接受TYMLOS共18个月患者中,49%(300/610)发生抗-abaloparatide抗体,这些中,68%(201/297)发生对abaloparatide中和抗体。. Of the有抗-abaloparatide抗体患者中被测试对交叉-反应性,2.3%(7/298)发生对PTHrP交叉-反应性,43%(3/7)发生对PTHrP中和抗体,和0%(0/298)发生对PTH交叉-反应性抗体。抗体形成没有表现出对安全性或疗效终点任何临床上意义影响,包括骨矿物质密度(BMD)反应,骨折减低,免疫-相关超敏性或过敏反应,或其他不良事件。
用TYMLOS治疗期间有抗-abaloparatide抗体患者的多数,85%(256/300),TYMLOS治疗完成后6个月有随访抗体测量。这些患者,56%(143/256)抗体仍阳性。
7 药物相互作用
未曽进行特异性药物-药物相互作用研究[见临床药理学(12.3)]。
8 在特殊人群中使用
8.1 妊娠
风险总结
在生殖潜能女性中TYMLOS不是使用的适应证。没有妊娠妇女TYMLOS使用的人数据告知任何药物风险。未曽进行用abaloparatide动物生殖研究。
8.2 哺乳
风险总结
在生殖潜能女性TYMLOS不是使用适应证。没有abaloparatide在人乳汁中存在,对哺乳喂养婴儿的影响,或对乳汁产生的影响的信息。
8.4 儿童使用
尚未确定在儿童患者中TYMLOS的安全性和有效性。不推荐TYMLOS使用在儿童患者有开放性骨垢板或易发生骨肉瘤遗传疾患因为增加基线骨肉瘤的风险[见警告和注意事项(5.1)]。
8.5 老年人使用
在TYMLOS的绝经后骨质疏松症临床研究患者总数中,82%为年龄65 岁和以上,和19%为年龄75岁和以上。这些受试者和较年轻受试者间未观察到安全性或有效性总体差别,但不能除外有些老年个体更大灵敏度。
8.6 肾受损
对有轻度,中度,或严重肾受损患者无需剂量调整。一项研究在有正常肾功能或轻度,中度,或严重肾受损受试者进行研究一个单次剂量的TYMLOS 80 µg 皮下给予。Abaloparatide的最高浓度(Cmax)和浓度-时间曲线下面积(AUC)分别增加1.4-和2.1-倍。在有严重肾受损受试者,与有正常肾功能受试者比较。有严重肾受损患者可能有增加abaloparatide暴露可能增加不良反应的风险;所以,监视不良反应[见临床药理学(12.3)]。
10 药物过量
在一项临床研究中,意外的过量被报道在一例患者在一天中接受400 µg(5倍推荐的临床剂量);给药被暂时地中断。患者经受衰弱,头痛,恶心,和眩晕。过量天不伴随血清钙,但下一天患者的血清钙是在正常范围内。药物过量的效应可能包括高钙血症,恶心,呕吐,眩晕,心动过速,体位性低血压,和头痛。
药物过量处理
对TYMLOS没有特异性抗毒药。怀疑过量的治疗应包括TYMLOS的终止,血清钙和磷的监视,和执行适当的支持措施,例如水化。根据分子量,血浆蛋白结合和分布容积,预计abaloparatide 是不能被透析。
11 一般描述
注射用TYMLOS为皮下给药含abaloparatide,一种合成的34氨基酸肽。Abaloparatide是一种人甲状旁腺激素相关肽,PTHrP(1-34)的类似物。它对hPTH(1-34)(人甲状旁腺激素1-34)有41%同源性和对hPTHrP(1-34)(人甲状旁腺激素-相关肽1-34) 76%同源性。
Abaloparatide有一个分子式C174 H300 N56 O49和一个分子量3961道尔顿有下面显示氨基酸序列:
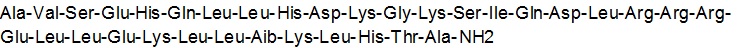
注射用TYMLOS是作为一个无菌,无色,清晰溶液在一个玻璃笔芯[cartridge]中供应它被预装至可遗弃单次-患者-使用笔中。该笔意向输送30每天1次abaloparatide剂量80 µg在40 µL。 每个笔芯含1.56 mL的TYMLOS溶液。每mL含2000 µg abaloparatide和以下无活性成分:5 mg 酚,5.08 mg三水乙酸钠,6.38 mg醋酸,和注射用水。
12 临床药理学
12.1 作用机制
Abaloparatide是一种PTHrP(1-34)类似物,它作用作为一种激动剂在PTH1受体(PTH1R)。这导致在靶细胞中cAMP信号通路的活化。在大鼠和猴中,abaloparatide对骨有一种同化效应,被在BMD和骨矿物质量(Bµ)增加所显与在脊椎和/或非脊椎部位骨力量增加相关[见非临床毒理学(13.2)]。
12.2 药效动力学
对骨更新标志物的影响
一项abaloparatide给药每天1次共24周的剂量发现研究显示对BMD和骨形成标志物一个剂量-反应相互关系。
在一项临床研究中,对有骨质疏松症绝经后妇女TYMLOS的每天给药增加骨形成标记物血清前胶原I型N-前肽[procollagen type I N-propeptide(PINP)]。在PINP水平中增加在月1达到峰值在基线上93%然后缓慢地随时间减低。在治疗期间的自始至终在PINP中增加是维持高于基线。在月18时,PINP浓度是约45%高于基线。在骨再吸收标志物中增加。血清I型胶原蛋白交联C-端肽[serum collagen type I cross-linked C-telopeptide(sCTX)]在月3时达到峰值在基线上43%然后在月18减低至基线上20%。
心脏电生理学
在55例健康受试者进行接受单次剂量的安慰剂一项4-因素交叉彻底QT/QTc研究,皮下剂量的abaloparatide在80 µg和240 µg(推荐剂量三倍),和莫西沙星[moxifloxacin]400 mg口服。用80 µg和240 µg给药后Abaloparatide增加心率,在首个时间点(15分钟)有一个均数峰分别增加15跳每分钟(bpm)和20 bpm。Abaloparatide对QTcI(个体化校正的QT间期)或心脏电生理学没有临床上有意义的的影响。
12.3 药代动力学
皮下给予abaloparatide 80 µg的7天后,均数(SD)abaloparatide暴露对Cmax为812(118) pg/mL和对AUC 0-24为1622(641) pg·hr/mL。
下面图1显示在绝经后妇女(N = 8)在天7时均数(SD)abaloparatide药代动力学图形。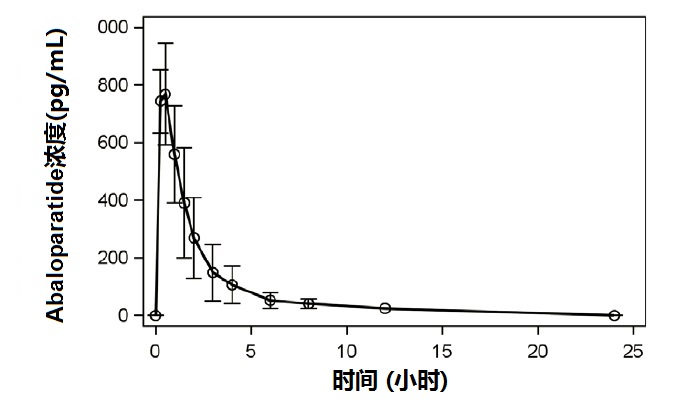
图1. 在绝经后妇女在天7时均数Abaloparatide药代动力学图形。
吸收
Abaloparatide 80 µg皮下给药后的达峰浓度的中位数时间(范围)为0.51 hr(0.25至0.52 hr)。 在健康妇女皮下给药一个80 µg剂量abaloparatide的绝对生物利用度为36%。
分布
Abaloparatide的体外血浆蛋白结合为约70%。分布容积为约50 L。
消除
Abaloparatide的均数(SD)半衰期为1.7(0.7) hrs。多肽片段为主要地通过肾排泄消除。
代谢
未曽用TYMLOS进行特异性代谢或排泄研究。Abaloparatid通过肾的代谢是与与非特异性水解降解至较小肽片段,接着通过肾清除一致。
特异性人群
老年患者
在绝经后妇女年龄范围从49至86岁未观察到在abaloparatide药代动力学中年龄-相关差别。
种族
在临床试验中根据种族未观察到在abaloparatide药代动力学中差别。
有肾受损患者
一项单次80 µg皮下剂量的abaloparatide被给予至男性和女性有肾受损患者:8例患者有轻度肾受损(CLCr 60至89 mL/min),7例患者有中度肾受损(CLCr 30至59 mL/min),8例患者有严重肾受损(CLCr 15至29 mL/min),和8例健康受试者有正常肾功能(CLCr 90或更大 mL/min)按性别,年龄,和机体质量指数(BMI)匹配。有轻度,中度,和严重肾受损患者,与有正常肾功能健康受试者比较Abaloparatide Cmax增加 1.0-,1.3-,和1.4-倍。有轻度,中度,和严重肾受损患者,与有正常肾功能健康受试者比较,Abaloparatide AUC增加1.2-,1.7-,和2.1-倍。在研究中没有包括进行透析患者。
药物相互作用
体外研究显示abaloparatide,在治疗浓度,不抑制或诱导细胞色素P450酶。
13 非临床毒理学
13.1 癌发生,突变发生,生育力受损
在一项2-年致癌性研究,abaloparatide被给予一天1次至雄性和雌性Fischer大鼠通过皮下注射在剂量10,25,和50 µg/kg。这些剂量导致全身暴露至abaloparatide分别在人推荐皮下剂量80 µg(基于AUC比较)后观察到全身暴露的4,16,和28 倍。用abaloparatide相关治疗的肿瘤变化由在所有雄性和雌性给药组在骨肉瘤和成骨细胞瘤[osteoblastoma]发生率明显的剂量依赖增加组成。在未治疗对照骨肉瘤的发生率为0-2%和在雄性和雌性高剂量组分别达到87%和62%。骨肿瘤是伴随骨肿块明显增加。
大鼠发现与人的相关联是不确定。处于骨肉瘤的风险增加患者建议不使用TYMLOS[见警告和注意事项(5.1)]。
在标测试包括Ames试验对细菌突变发生,利用人外周血淋巴细胞染色体畸变试验和小鼠微核试验中,Abaloparatide没有遗传毒性或致突变性。
13.2 动物毒理学和药理学
在毒性研究中在大鼠和猴分别至26-周和39-周时间,发现包括血管扩张,在血清钙中增加,在血清磷减低,和软组织矿物质化在剂量≥10 µg/kg/day。这个10 µg/kg/day剂量导致全身暴露至abaloparatide在大鼠和猴分别为在人在每天皮下剂量80 µg暴露2和3倍。
在12-和16-个月研究在卵巢切除(OVX)大鼠和猴,在剂量至分别人暴露在推荐皮下剂量80 µg,(基于AUC 比较)11和1倍评价abaloparatide对骨骼的药理学影响。在这些绝经后骨质疏松症动物模型中,用abaloparatide治疗导致在椎体和/或非椎体部位在骨质量剂量依赖增加,相关于骨力量增加。Abaloparatide的同化效应是由于在成骨细胞骨形成中主要增加和被在骨小梁厚度和/或皮质厚度增加证据由于骨内膜骨并列[endosteal bone apposition]。Abaloparatide 维持或改善骨质量在所有被评价的骨部位和不致任何矿物质化缺陷。
14 临床研究
在有绝经后骨质疏松症妇女中疗效研究
在研究003(NCT 01343004)评价为绝经后骨质疏松症的治疗TYMLOS的疗效,一项18-个月,随机化,多中心,双盲,安慰剂-对照临床试验在绝经后妇女年龄49至86岁(均数年龄69)患者被随机化接受TYMLOS 80 µg(N = 824)或安慰剂(N = 821)给予皮下地每天1次。约80%患者为高加索人,16%为亚裔和3%为黑种人;24%为西班牙裔。在基线时,均数T-评分为-2.9在腰椎,-2.1在股骨颈处,和-1.9在总股骨。在基线时,24%患者有至少一个流行椎体骨折和48% 有至少一个以前非椎骨骨折。患者每天服用补充钙(500至1000 mg)和维生素D(400至800 IU)。
疗效研究被延伸作为研究005(NCT 01657162),一项开放研究其中患者是再也不接受TYMLOS或安慰剂单是维持在他们的原先随机化治疗组和接受70 mg阿仑膦酸钠每周,与钙和维生素D补充共6个月。研究005纳入1139例患者,代表92%完成研究003患者。这包括558例患者以前曽接受TYMLOS和581例患者以前曽接受安慰剂。累计的25-个月疗效数据组包括18个月暴露至TYMLOS或安慰剂在研究003,1个月无治疗,接着被6个月的阿仑膦酸钠治疗在研究005。
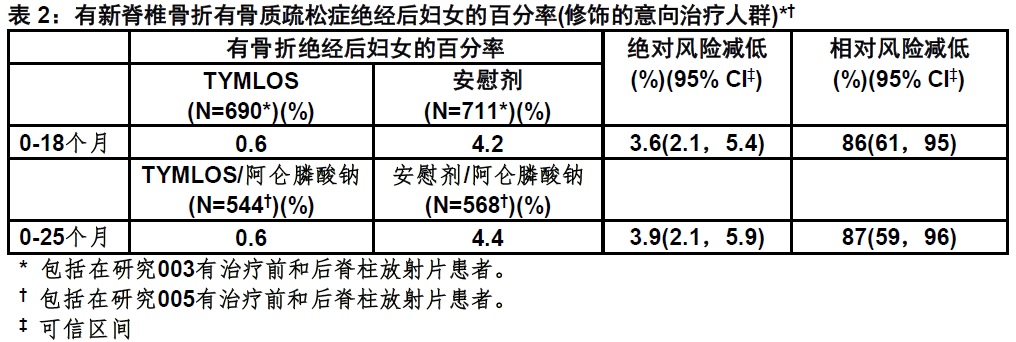
对新脊椎骨折影响
主要终点是在用TYMLOS治疗患者与安慰剂比较新脊椎骨折的发生率。在18个月与安慰剂比较,TYMLOS导致在新脊椎骨折的发生率一个显著减低(TYMLOS 0.6%与安慰剂4.2%比较,p <0.0001)。对TYMLOS 与安慰剂比较,在18个月新脊椎骨折的绝对风险减低为3.6%和相对风险减低为86%(表2)。在25个月时用TYMLOS治疗然后阿仑膦酸钠患者新脊椎骨折的发生率为0.6%,与之比较,在用安慰剂治疗然后阿仑膦酸钠患者为4.4% (p <0.0001)。在25个月时对用TYMLOS治疗然后阿仑膦酸钠患者新脊椎骨折相对风险减低为87%,与之比较,用安慰剂治疗然后阿仑膦酸钠患者,和绝对风险减低为3.9%(表2)。
对非脊椎骨折影响
TYMLOS 导致在18个月的治疗加1个月随访结束时非脊椎骨折的发生率一个显著减低这时没有给予药物对TYMLOS-治疗患者(2.7%与之比较对安慰剂-治疗患者4.7%)。对TYMLOS与安慰剂比较非脊椎骨折的相对减低为43%(对数秩检验[logrank test] p = 0.049)和绝对风险减低为2.0%。
在研究005阿仑膦酸钠治疗6个月后,在25个月时在以前TYMLOS组妇女非脊椎骨折的累计发生率为2.7%与之比较,对在以前安慰剂组妇女为5.6% (图2)。在25个月时,在非脊椎骨折中相对风险减低为52%(对数秩检验p = 0.017)和绝对风险减低为2.9%。
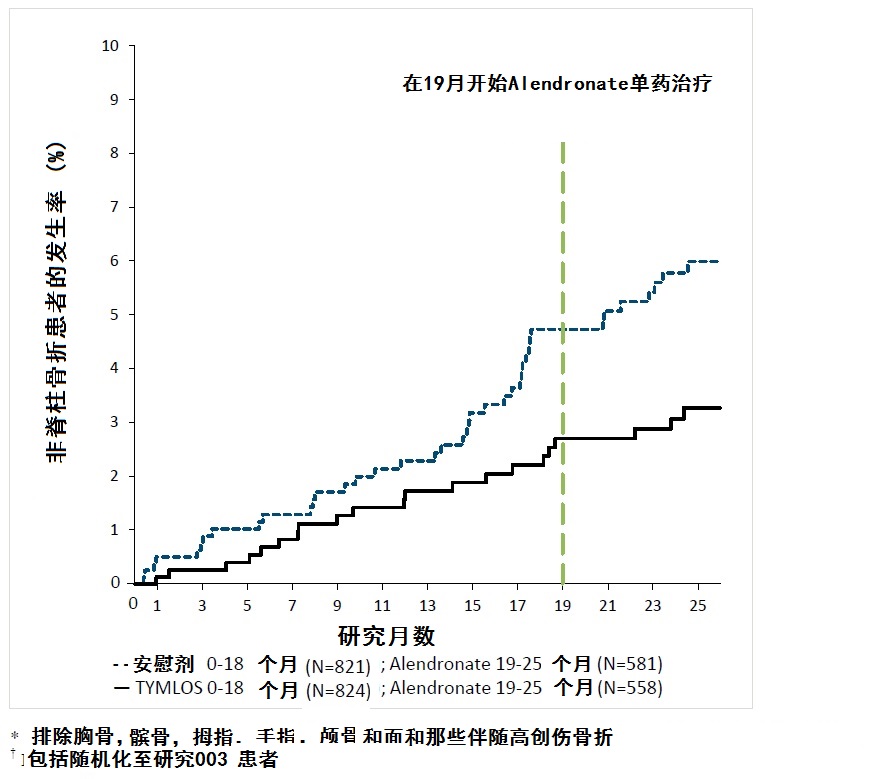
图2.历时25个月非脊椎骨折*的累计发生率(意向治疗人群†
*排除胸骨,髌骨,拇指,手指,颅骨和面和患者伴随有高创伤。† 包括患者随机化在研究003 TYMLOS显示一致减低在椎体和非脊椎骨折的风险不管年龄,自停经年,存在或缺乏以前骨折(椎体,非椎体)和在基线时BMD。对骨矿物质密度(BMD)用TYMLOS治疗共18个月影响在研究003导致在腰椎,总体股骨和股骨颈,与安慰剂比较BMD显著增加各个有p<0.0001(表3)。在研究005中阿仑膦酸钠治疗6个月后见到相似发现(表3)。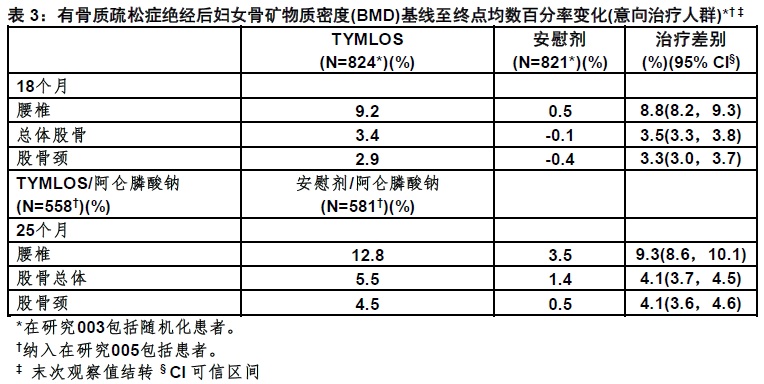
TYMLOS显示BMD一致增加不管年龄,自停经后年,种族,民族,地理区域,存在或缺乏以前骨折(椎体,非椎体),和在基线时BMD。.
对骨组织学影响
从71例有骨质疏松症患者在治疗后12 – 18个月得到骨活检样品(36个在TYMLOS组和35个在安慰剂组)。得到的活检中,55个是适宜为定量组织形态学计量评估(27个在TYMLOS组和28 个在安慰剂组)。定性和定量组织学评估显示正常骨结构和无非层板骨[woven bone],骨髓纤维化,或矿物质化缺陷的证据。
16 如何供应/贮存和处置
16.1 如何供应
注射用TYMLOS是作为一个预先装配单次-患者-使用可遗弃的笔供应(NDC 70539-001-01)包装在一个纸板箱(NDC 70539-001-02)与使用指导和用药指南。每个可遗弃的笔包含一个玻璃笔芯含3120 µg的abaloparatide在1.56 mL(2000 µg/mL)的无菌消毒,清晰,无色液体。每支笔提供一个30-天供应为每天1次注射的80 µg abaloparatide 在40 µL中。
不包括无菌针头。
16.2 贮存和处置
●首次使用前,贮存TYMLOS在冰箱2°C至8°C间(36°F至46°F)。
●首次使用后,贮存直至30天在20°C至25°C(68°F to 至77°F)。.
● 不要冻结或受热。
17 患者咨询资料
建议患者阅读FDA-批准的患者说明书(用药指南和使用指导).
骨肉瘤的风险
忠告患者在TYMLOS中活性成分,abaloparatide,在雄性和雌性大鼠致一个剂量依赖增加骨肉瘤的发生率和不知道在人中TYMLOS是否将致骨肉瘤[见警告和注意事项(5.1)]。
指导患者及时报告可能性骨肉瘤的体征和症状例如持续局部化疼痛或一个新软组织肿块触摸疼的发生。
高钙血症
忠告患者TYMLOS可能致高钙血症和讨论高钙血症的症状(如,恶心,呕吐,便秘,嗜睡,肌肉软弱)[见警告和注意事项(5.3)]。
指导患者即使报告高钙血症的体征和症状.
体位性低血压
建议患者坐下或躺下如他们注射后感觉头重脚轻或有心悸直至他们的症状解决。如这些 症状持续或变坏,建议患者在继续治疗前咨询他们的卫生保健提供者[见剂量和给药方法(2.2)]。
TYMLOS笔的使用
指导给予TYMLOS患者和护理人员如何适当地使用TYMLOS笔和遵循尖锐遗弃建议[见剂量和给药方法(2.2)]。建议患者不要与其他患者共享他们的TYMLOS笔或针头和不要转移笔内容至一个注射器。
忠告患者每支TYMLOS笔可被使用至30天,和30-天使用期后,遗弃TYMLOS笔,即使如它仍含未使用溶液[见如何供应/贮存和处置(16.2)]。

