批准日期:2017年2月9日:公司:Marathon Pharmaceuticals,LLC
美国FDA批准药物治疗杜氏[Duchenne]肌肉萎缩
第一个FDA批准治疗DMD的任何皮质激素和deflazacort在美国第一个批准的任何使用。
FDA的药品评价和研究中心内神经学产品部主任说:“这是对一个有杜氏肌肉营养障碍宽广范围患者首次被批准治疗,” “我们希望这个治疗将有益于有DMD许多患者。” 快速通道指定和优先审评。孤儿罕见药物指定,罕见儿童疾病优先审评凭证
http://www.accessdata.fda.gov/drugsatfda_docs/label/2017/208684s000,208685s000lbl.pdf
处方资料重点
这些重点不包括安全和有效使用EMFLAZA™需所有资料。请参阅EMFLAZA完整处方资料。
EMFLAZA(deflazacort)片,为口服使用 EMFLAZA(deflazacort)口服悬液
美国初次批准:2017
适应证和用途
EMFLAZA是一种皮质激素适用为治疗5岁和以上杜氏肌肉营养不良障碍(DMD)患者(1)
剂量和给药方法
● 推荐的每天剂量是约0.9 mg/kg/day口服给予(2.1)
●当给予共多于少数几天逐渐地终止(2.2)
剂型和规格
● 片:6 mg,18 mg,30 mg,和36 mg(3)
● 口服悬液:22.75 mg/mL(3)
禁忌证
对deflazacort或在EMFLAZA活性成分中任何超敏性(4)
警告和注意事项
● 内分泌功能中变化:可能发生下脑丘垂体肾上腺轴抑制,库兴氏综合征,和高血糖;有EMFLAZA的慢性使用对这些情况监视患者(2.2,5.1)
● 免疫抑制和感染的风险增加:新,加重,播散的风险增加,或潜伏感染的再活化,它可能是严重和有时是致命的;感染的体征和症状可能被掩盖(5.2)
● 在心血管/肾功能中变化:监视对升高的血压和钠,和对减低的钾水平(5.3)
● 胃肠道穿孔:在有某些GI疾患患者风险增加;体征和症状可能被掩盖(5.4)
● 行为和情绪骚乱:可能包括欣快感,失眠,情绪波动,性格转变,严重抑郁,和精神病(5.5)
● 对骨影响:有EMFLAZA的慢性使用监视对骨密度中减低(5.6)
● 眼科效应:可能包括白内障,感染,和青光眼;监视眼内压如EMFLAZA被继续共超过6周(5.7)
● 免疫接种:不要给活或活减弱疫苗至患者接受免疫抑制剂量的皮质激素(5.8)
● 严重的皮肤皮疹:终止在首次皮疹征象时,除非皮疹清除与药物无关联(5.9)
不良反应
最常见不良反应(≥ 10%对EMFLAZA和大于安慰剂)是库欣样外观,体重增加,食欲增加,上呼吸道感染,咳嗽,尿频,多毛症,中央性肥胖,和鼻咽炎(6.1)
药物相互作用
● 中度或强CYP3A4抑制剂:给予三分之一推荐剂量的EMFLAZA(7.1)
● 避免使用中度或强CYP3A4诱导剂与EMFLAZA,因为它们可能减低疗效(7.1)
报告怀疑不良反应,联系Marathon制药,LLC at 1-866-562-4620或DrugSafety@propharmagroup.com或FDA at 1-800-FDA-1088或www.fda.gov/medwatch.
完整处方资料
1 适应证和用途
EMFLAZA是适用为5岁和以上杜氏肌肉营养不良障碍(DMD)患者的治疗.
2 剂量和给药方法
2.1 给药信息
EMFLAZA的推荐度口服剂量是约0.9 mg/kg/day每天1次。如片被使用,取最近可能整数剂量。可用四片EMFLAZA强度的任何组合实现这个剂量。如使用口服悬液取整至一毫升(mL)的最近十分之一。
2.2 终止
EMFLAZA的剂量必须逐渐地减低如药物被给予共超过几天[见警告和注意事项(5.1)] .
2.3 重要制备和给药指导
EMFLAZA片和口服悬液可有或无食物服用。
EMFLAZA片
EMFLAZA片可被整片给予或弄碎和与苹果汁混合后立即服用。
EMFLAZA口服悬液
在给药前成分摇动 EMFLAZA口服悬液。
仅使用随产品提供的口服分配器。抽吸适当剂量至口服分配器后,缓慢地加入EMFLAZA口服悬液入3至4 盎司的汁或奶和充分混合。然后应立即给予该剂量。不要与葡萄柚汁给予EMFLAZA [见药物相互作用(7.1)]。
在第一次打开瓶后1个月后遗弃残留的任何未使用EMFLAZA口服悬液。
2.4 对与CYP3A4抑制剂和诱导剂使用剂量调整
CYP3A4抑制剂
当EMFLAZA与中度或强CYP3A4抑制剂被给予时给予三分之一 推荐剂量。例如, 当与中度或强CYP3A4抑制剂使用时一个36 mg每天剂量将被减低至12 mg每天剂量[见药物相互作用(7.1)和临床药理学(12.3)]。
CYP3A诱导剂
避免与中度或强CYP3A4诱导剂与EMFLAZA使用[见药物相互作用(7.1)和临床药理学(12.3)]。
3 剂型和规格
片
● 6 mg:白色和圆在一侧凹有“6”
● 18 mg:白色和圆在一侧凹有“18”
● 30 mg:白色和卵圆在一侧凹有“30”
● 36 mg:白色和卵圆在一侧凹有“36”
口服悬液
● 22.75 mg/mL:白色悬浮液
4 禁忌证
在有已知对deflazacort或对活性成分中任何超敏性禁忌EMFLAZA。接受皮质激素治疗患者曽发生超敏性的情况,包括过敏反应[见警告和注意事项(5.15)和不良反应(6.2)]。
5 警告和注意事项
5.1 内分泌功能改变
皮质激素,例如EMFLAZA,可致严重和危及生命内分泌功能中变化,特别随慢性使用。监视患者接受EMFLAZA对库兴氏综合征,高血糖,和撤用EMFLAZA后肾上腺功能不全。此外,有垂体机能减退,原发性肾上腺功能不全或先天肾上腺增生,甲状腺功能变化,或嗜铬细胞瘤患者可能是处于不良内分泌事件风险。
皮质激素撤去后肾上腺功能不全风险
皮质激素产生可逆性下丘脑垂体肾上腺(HPA)轴抑制,皮质激素治疗的撤去后有继发性肾上腺功能不全发生发展的潜能。如突然撤去皮质激素发生急性肾上腺功能不全,而可能是致敏性。患者中肾上腺皮质功能不全的程度和时间是变异的和依赖于皮质激素治疗的剂量,频数,和时间。通过逐渐地锥形调低皮质激素剂量当撤去治疗时减低风险。这个不足可能持续久,但是,长期治疗的终止后共数月;所以,在终止阶段时应急发生的任何情况,应重新开始皮质激素治疗。对早已服用皮质激素患者在应急的时间期间,剂量可能需要被增加。
一种类固醇“撤药综合证[withdrawal syndrome],”似乎与肾上腺皮质激素功能不全无关,可能也发生也发生在皮质激素突然终止后。这个综合证包括症状例如厌食,恶心,呕吐,昏睡,头痛,发热,关节痛,脱屑,肌肉痛,和/或体重减轻。这些效应欸认为是由于皮质激素浓度突然变化而不是低皮质激素水平。
库兴氏综合征
随延长暴露至外源性皮质激素,包括EMFLAZA发生库兴氏综合征(皮质醇过多症)。症状包括高血压,躯干性肥胖和四肢变瘦,皮肤紫纹,facial rounding,多血质外貌,肌肉软弱,容易和频繁瘀伤有薄脆皮肤,颈后脂肪沉积,骨质减少,痤疮,无月经,多毛症和精神异常。
高血糖
皮质激素可增加血糖,预先存在糖尿病恶化,长期治疗患者易患糖尿病,和可能减低抗糖尿病药物的效应。在规则间隔监视血糖。对有高血糖患者,应开始抗-糖尿病治疗或因此调整。.
在有甲状腺功能变化患者为使用考虑
在甲状腺机能减退的患者皮质激素的代谢性清除被减低和甲状腺功能亢进患者增加。患者的甲状腺状态变化可能需要皮质激素的剂量调整。当同时给予皮质激素和左旋甲状腺素被要求,皮质激素的给予应在左旋甲状腺素治疗开始前以减低肾上腺病危期风险。
嗜铬细胞瘤病危期
全身皮质激素给药后曽有嗜铬细胞瘤病危期的报告,它可能致命。在患者怀疑或鉴定嗜铬细胞瘤,给予皮质激素前考虑嗜铬细胞瘤病危期风险。
5.2 免疫抑制和感染的风险增加
皮质激素,包括EMFLAZA,抑制免疫系统和任何病原体感染风险增加,包括病毒,细菌,真菌,原虫,或蠕虫。皮质激素减低对新感染抗力,加重存在的感染,增加被播散感染的风险,增加潜伏感染再次活化或加重风险,和掩盖某些感染的体征。这些感染可能是严重,和有时是致命的。皮质激素给予剂量,途径,和时间与感染的特异性风险相关程度没有充分描述特征;但是,感染合并症的发生率随皮质激素剂量增加而增加。
监视对感染的发生发展和需要时考虑撤去皮质激素或减低皮质激素剂量。
带状疱疹病毒和麻疹病毒感染
在非-免疫儿童或成年用皮质激素,包括EMFLAZA由带状疱疹病毒和麻疹所致水痘可能有一个严重或甚至致命过程。在未曽有这些疾病儿童或成年,应采取特别护理避免暴露。如一例患者被暴露至水痘,可能适应用带状疱疹病毒免疫球蛋白(VZIG)预防。如果一例患者被暴露于麻疹,可能被适应用免疫球蛋白(IG)预防。如发生水痘,可能被考虑用抗病毒剂治疗。
乙型肝炎病毒再次活化
在患者是乙型肝炎携带者正在进行用免疫抑制药物包括皮质激素治疗可能发生乙型肝炎病毒再次活化。在表现有已解决的乙型肝炎感染患者也可能发生再次活化。
真菌感染
皮质激素可能加重全身真菌感染和所以在存在这类感染不应使用。对用皮质激素患者发生全身真菌感染,建议撤去皮质激素或减低皮质激素的剂量。
阿米巴病
皮质激素可能活化潜伏阿米巴病. 所以,建议在任何曽在热带住一些时间的患者,或任何有不能解释腹泻的患者开始皮质激素治疗前除外潜伏阿米巴病或活动性阿米巴病。
结线虫感染
在有已知或怀疑结线虫(threadworm)虫染患者中,皮质激素诱导免疫抑制可能导致结线虫 过度感染和播散有分布广泛的幼虫移动,往往伴随严重小肠结肠炎和潜在致敏性格兰-阴性败血症。对患者用皮质激素发生已知或怀疑结线虫感染,建议撤去皮质激素或减低皮质激素剂量。
5.3 心血管/肾功能中改变
皮质激素,包括EMFLAZA,可致血压升高,盐,和水潴留,和增加钾和钙的排泄。监视血压和评估对容积负荷的体征和症状。监视血清钾水平。可能需要限制膳食盐和补充钾。 EMFLAZA应被使用与小心谨慎在患者有充血性心衰,高血压,或肾功能不全。
文献报道提示皮质激素的使用和左心室free最近心肌梗死后壁破裂相关;所以,在这些患者用EMFLAZA治疗应很大小心谨慎。
5.4 胃穿孔
在患者有某些胃肠道疾患例如活动性或潜伏胃溃疡,憩室炎,新鲜小肠吻合,和非-特异性溃疡性结肠炎皮质激素使用期间胃穿孔的风险增加。胃肠道穿孔的体征,例如腹膜刺激,在接受皮质激素患者可能被掩盖。
如有即将穿孔,脓肿,或其他化脓感染;憩室炎;新鲜小肠吻合;或活动性或潜伏胃溃疡的概率避免皮质激素。
5.5 行为和情绪障碍
用全身皮质激素,包括EMFLAZA可能发生潜在地严重精神不良反。症状典型地出现在开始治疗的几天或周内和可能是剂量相关。在或剂量减低或撤去后这些反应可能改善,虽然可能需要药理学治疗。精神不良反应通常涉及轻躁狂或狂躁症状(如,欣快感,失眠,情绪波动)治疗期间和治疗的终止后抑郁情节。告知患者或护理人员对行为和情绪变化潜能和鼓励他们寻求医学关注如精神症状发生,特别如怀疑抑郁情绪或自杀观念。
5.6 对骨效应
减低的骨密度
皮质激素,包括EMFLAZA,减低骨形成和增加骨再吸收两者都通过它们对钙调节作用(即,减低吸收和增加排泄)和成骨细胞的抑制作用。这个,与继发于蛋白降解代谢中增加和性激素产生的减低骨的蛋白基质的减低在一起,可能导致在儿童患者中骨生长的抑制和任何年龄中骨丢失的发展。骨丢失可能患者易患脊椎和长骨骨折。考虑开始皮质激素治疗前一个患者的骨质疏松症风险。在用EMFLAZA长期治疗患者监视骨密度。
无血管性坏死
皮质激素,包括EMFLAZA,可能致无血管坏死。.
5.7 眼效应
皮质激素的使用,包括EMFLAZA,可能产生晶体囊后部白内障。皮质激素还可能致青光眼 有可能损伤至眼神经,而且通过细菌,真菌,或病毒致继发性眼感染风险增加。对有活动性眼单纯疱疹患者建议不用皮质激素。
有些用皮质激素患者眼内压可能成为升高。如用EMFLAZA治疗继续共6周以上,监视眼内压。
5.8 免疫接种
在接受免疫皮质激素的免疫抑制剂量,包括EMFLAZA患者建议不给予活或活减弱疫苗。皮质激素在活减弱疫苗中可能含某些有机体复制潜能。
皮质激素治疗期间可能给予杀死或未灭活疫苗;但是,对这类疫苗反应不能被预测。
用皮质激素治疗,包括EMFLAZA患者,可能表现出对类毒素和或未活化疫苗的消除反应因为抗体反应的抑制作用。
5.9 严重皮肤皮疹
开始治疗的8周内曽报道随deflazacort使用有症状毒性上皮坏死。在皮疹的首次体征时终止,除非皮疹是与药物无相关被清除。
5.10 对生长和发育效应
皮质激素的长期使用,包括EMFLAZA,在儿童中对生长和发育效应可能有阴性。
5.11 肌病变
患者接受皮质激素,包括EMFLAZA,和同时用神经肌肉阻断剂治疗(如,泮库溴铵[pancuronium])或患者有神经肌肉传导疾患(如,重症肌无力)可能是处于发生急性肌肉病风险增加。这个急性肌病变被普遍化,可能涉及眼和呼吸肌肉,和可能导致四肢轻瘫。可能发生肌酐激酶升高。停止皮质激素后临床改善或恢复可能需要周至年。
5.12 Kaposi氏肉瘤
在接受皮质激素治疗患者中曽报道发生Kaposi氏肉瘤,大多数常为慢性条件。皮质激素的终止可能导致临床改善。
5.13 由于苯甲醇防止婴儿严重不良反应的风险
EMFLAZA口服悬液含苯甲醇和是没有批准为低于5岁儿童患者使用。严重和致命性不良反应 包括“喘息综合征[gasping syndrome]”在新生儿和底出生体重婴儿用苯甲醇-预处理药物治疗可能发生。 “喘息综合征”特征是中枢神经系统抑郁,代谢性酸中毒,和喘气呼吸。不知道严重不良反应可能发生最小苯甲醇的量(EMFLAZA口服悬液含10.45 mg的苯甲醇每mL;EMFLAZA片不含苯甲醇) [见特殊人群中使用(8.4)]。
5.14 血栓栓塞事件
观察性研究曽显示血栓栓塞风险增加(包括静脉血栓栓塞)特别地有较高累积剂量的皮质激素。不清楚按每天剂量或使用时间风险是否不同。有或可能对血栓栓塞疾患易患患者谨慎使用EMFLAZA。
5.15 过敏反应
在接受皮质激素治疗,包括EMFLAZA患者过敏反应曽发生罕见情况。
6 不良反应
在其他节中更详细讨论以下严重不良反应:
● 内分泌功能改变[见警告和注意事项(5.1)]
● 免疫抑制和感染的风险增加 [见警告和注意事项(5.2)]
● 心血管/肾功能中改变[见警告和注意事项(5.3)]
● 胃穿孔[见警告和注意事项(5.4)]
● 行为和情绪障碍[见警告和注意事项(5.5)]
● 对骨效应[见警告和注意事项(5.6)]
● 眼效应[见警告和注意事项(5.7)]
● 免疫接种[见警告和注意事项(5.8)]
● 严重皮肤皮疹[见警告和注意事项5.9)]
● 对生长和发育效应[见警告和注意事项(5.10)]
● 肌病变[见警告和注意事项(5.11)]
● Kaposi氏肉瘤[见警告和注意事项(5.12)]
● 由于苯甲醇防止婴儿严重不良反应的风险[见警告和注意事项(5.13)]
● 血栓栓塞事件[见警告和注意事项(5.14)]
● 过敏反应[见警告和注意事项5.15)]
6.1 临床试验经验
因为临床试验是在广泛不同情况下进行的,临床试验观察到不良反应率不能与另一种药临床试验发生率直接比较而且可能不反映实践中观察到的发生率。
在研究1 [见临床研究(14)],是伴随deflazacort治疗终止不良反应,以频数降序,为体重增加,肥胖,白内障,和睡眠障碍。.
在临床研究中最常见不良反应
表1列出在研究1中不良反应发生在≥ 5%患者在0.9 mg/kg/day deflazacort-治疗组和发生较频于安慰剂患者,其中包括有DMD年龄5和15岁间患者。
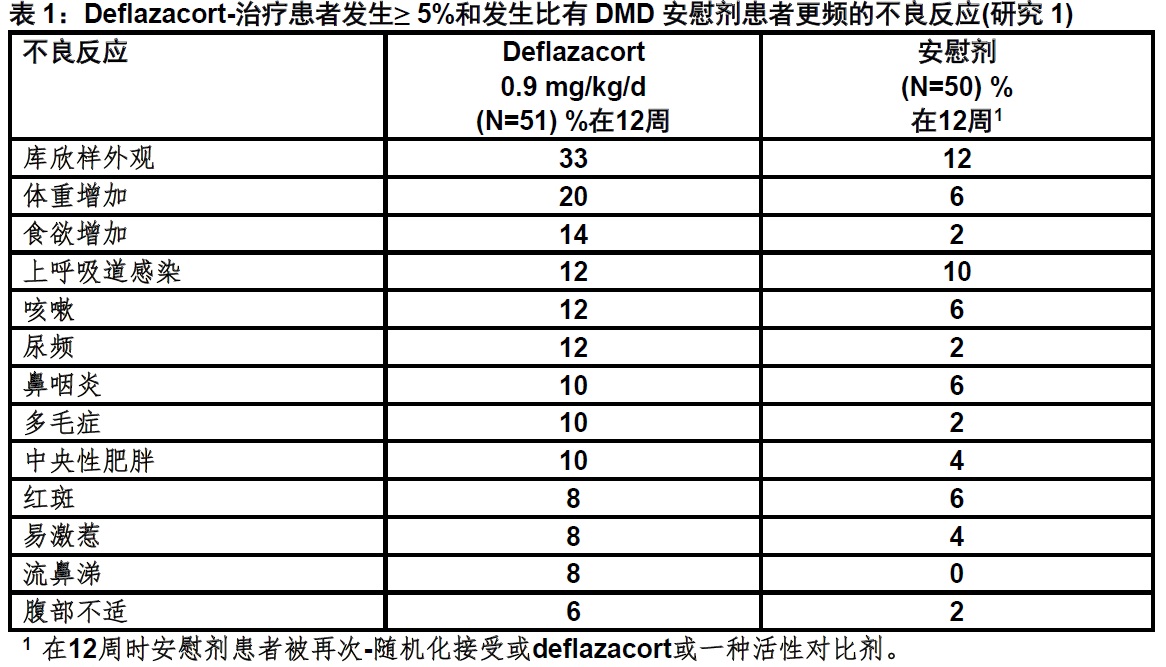
在研究1中发生暴露于deflazacort 0.9 mg/kg/day超过52周常见不良反应(≥ 5%的deflazacort-治疗患者)至和在试验的12-周安慰剂-对照期中在一个比deflazacort 0.9 mg/kg/day较高率,包括库欣样外观(60%),多毛症(35%),体重增加(28%),红斑(28%),中央性肥胖(25%),腹痛/上腹痛(18%组合),尿频(15%),便秘(10%),易激惹(10%),异常行为(9%),发热(9%),背痛(7%),皮疹(7%),混乱(6%),恶心(6%),精神运动过度反应性(6%),鼻出血(6%),和皮肤条纹(6%)。
研究1还评价一个较高的剂量deflazacort(1.2 mg/kg/day)。与0.9 mg/kg/day剂量比较,deflazacort 1.2 mg/kg/day历时52周是伴随某些不良反应一个较高发生率,包括库欣样外观(69%),红斑(49%),多毛症(37%),头痛(34%),体重增加(32%),便秘(15%),上腹痛(14%),皮肤条纹(11%),痤疮(11%),和腹部不适(8%)。因为用1.2 mg/kg/day剂量deflazacort没有增加获益,对DMD治疗不建议使用EMFLAZA 1.2 mg/kg/day[见剂量和给药方法(2.1)]
在一项另外两年时间的临床研究有延伸随访(研究2),观察到许多相同不良反应。此外,还观察到伴随长期甾体使用肌肉骨骼事件,包括肌肉软弱,肌腱病,和骨质减少。
在临床研究中观察到的较不常见不良反应
在下面显示研究1的12-周安慰剂-对照期时观察到的其他不良反应(≥ 1%频数在任何deflazacort治疗组和大于安慰剂):
眼疾患:流泪增加
胃肠道疾患:消化不良,恶心,胃肠道疾患
一般疾患和胃药部位情况:口渴感染:睑腺炎,脓疱病,流感,外耳炎,咽炎,牙脓肿,尿道感染,病毒感染
损伤,中毒和程序并发症:背损伤,混乱,面损伤,腓骨骨折,柳枝骨折,热耗竭
调查研究:存在尿糖,心率不规则
肌肉骨骼和结缔组织疾患:背痛,肌肉痉挛,肌肉痛,颈部肿块,颈痛,四肢痛
神经系统疾患:眩晕,精神运动过度反应性
精神疾患:影响不稳定,攻击性,抑郁,情绪疾患,中期型失眠,情绪变化,情绪波动,睡眠疾患
肾和泌尿疾患:色素尿,排尿困难,高张性膀胱
生殖系统和乳腺疾患:睾丸痛
呼吸,胸,和纵隔疾患:通气减少,流鼻涕
皮肤和皮下组织疾患:痤疮,脱发,痤疮样皮炎
血管疾患:热潮红
6.2 上市后经验
在deflazacort批准后使用期间,世界范围或其他皮质激素批准后使用期间曽报道以下不良反应。这些反应是自愿地来自人群大小不确定;所以,总是不可能估计它们的频数或确定药物暴露因果相互关系。
血液和淋巴系统疾患:白细胞增多
心脏疾患:心衰
眼疾患:脉络膜视网膜病,角膜或巩膜变薄
胃肠道疾患:急性胰腺炎(特别在儿童),出血,消化道溃疡,消化性溃疡穿孔
一般疾患和胃药部位情况:水肿,受损愈合
免疫系统疾患:超敏性 包括过敏反应
代谢和营养疾患:当与β2-激动剂和黄嘌呤共同给药时受损的碳水化合物耐受量随对抗糖尿病治疗要求,阴性蛋白和钙平衡,钾丢失和低钾性碱中毒而增加
肌肉骨骼和结缔组织疾患:无血管坏死,肌肉消,阴性氮平衡,当与喹诺酮类[quinolones]共同给药肌腱炎和肌腱破裂,脊椎和长骨骨折。
神经系统疾患:癫痫加重,在儿童(脑假瘤)通常治疗撤去后增加颅内压有视神级乳头水肿,眩晕
精神疾患:焦虑,认知功能失调包括混乱和失忆症,妄想,幻觉,躁狂,自杀想法
皮肤和皮下组织疾患:毒性上皮坏死
血管疾患:血栓栓塞,特别是在患者有潜在条件伴随增加血栓倾向,良性颅内高压
7 药物相互作用
7.1 CYP3A4抑制剂和诱导剂
中度或强CYP3A4抑制剂:
Deflazacort的活性代谢物,21-desDFZ,是CYP3A4的底物[见临床药理学(12.3)]。Deflazacort与克拉霉素[clarithromycin],一种强CYP3A4抑制剂共同给药,增加对21-desDFZ总暴露约3-倍。所以,当中度或强CYP3A4抑制剂(如.,克拉霉素,氟康唑[fluconazole],地尔硫卓[diltiazem],维拉帕米[verapamil],葡萄柚汁)是与EMFLAZA同时使用给予三分之一推荐剂量的EMFLAZA [见剂量和给药方法(2.4)和临床药理学(12.3)]。
中度或强CYP3A4诱导剂:
Deflazacort与利福平,一种强CYP3A4诱导剂共同给药,显著地减低21-desDFZ的暴露。避免强(如,依法韦仑[efavirenz])或中度(如,卡马西[carbamazepine],苯妥英[phenytoin]) CYP3A4诱导剂与EMFLAZA同时使用[见剂量和给药方法(2.4)和临床药理学(12.3)]。
7.2 神经肌肉阻断剂
患者接受皮质激素,包括EMFLAZA,和同时用神经肌肉阻断药物治疗(如,泮库溴铵)可能是处于发生一种急性肌病变风险增加[见警告和注意事项(5.11)]。
8 特殊人群中使用
8.1 妊娠
风险总结
妊娠期间仅如潜在获益胜过对胎儿潜在风险才应使用皮质激素。婴儿出生母亲在妊娠期间曽接受实质剂量的皮质激素应被仔细地观察肾上腺功能减退的体征。在妊娠妇女中没有用EMFLAZA适当和对照良好的研究告知药物关联风险。
皮质激素,包括EMFLAZA,容易跨越胎盘。不良发育结局,包括口面裂(裂春,有或无裂颚)和妊娠期间子宫内生长受限制,和随皮质激素使用曽报道减低出生体重,皮质激素,包括EMFLAZA。有些流行病学研究告口面裂的风险增加来自约1/1000/婴儿至3-5每1000婴儿;但是,在所有研究中未观察到口面裂风险。子宫内生长限制和出生体重减低似乎是剂量相关;但是,潜在母体情况也可能对这些风险有贡献(见数据)。不知道对适应人群主要出生缺陷和流产的估算背景风险。在美国一般人群中,主要出生缺陷和在临床上认可妊娠中流产的估算背景风险分别是2-4%和15-20%。
未曽用deflazacort进行动物生殖研究。在其他皮质激素进行动物生殖研究妊娠小鼠,大鼠,仓鼠,和兔中进行利用临床上相关剂量曽显示裂颚的发生率增加。在胚胎胎儿死亡增加,子宫内生长滞后,和在有些动物种属中观察到导管动脉的收缩。
数据
人数据
在人中多队列和病例-对照研究提示在第一个三个月期间皮质激素使用增加裂唇率有或无裂颚来自约1/1000婴儿至在至3-5/1000婴儿。两项前瞻性病例-对照研究显示在婴儿在子宫内暴露于母体皮质激素减低出生体重。.
8.2 哺乳
风险总结
全身地给予皮质激素出现在人乳汁中和可能抑制生长,干扰内源性皮质激素产生,或致其他不想要的效应。哺乳喂养的发育和健康获益应被与母亲对EMFLAZA的临床需求和哺乳喂养婴儿来自 EMFLAZA任何潜在不良效应一起考虑。对乳汁产生发影响没有数据。
8.4 儿童使用
已确定在5岁和以上DMD患者EMFLAZA治疗的安全性和有效性。EMFLAZA在儿童患者的使用被在196男性一项多中心,随机化,双盲,安慰剂-和活性-对照研究支持[见临床研究(14)]。
尚未确定低于5岁儿童患者EMFLAZA的安全性和有效性。
含苯甲醇EMFLAZA口服悬液和未被批准为低于5岁儿童患者中使用。严重不良反应包括致敏性反应和在早产儿中发生“喘息综合征”和在新生儿重症监护室中接受含作为防腐剂苯甲醇低出生体重婴儿。在这些病例中,苯甲醇剂量99至234 mg/kg/day产生在血和尿中高水平苯甲醇及其代谢物(血水平为0.61 to 1.378 mmol/L)。附加不良反应包括逐渐神经学恶化,癫痫,颅内出血,血液学异常,皮肤分解,肝和肾衰竭,低血压,心动过缓,和心血管崩溃。早产,低-出生体重婴儿可能是更容易发生这些反应因为他们可能是较不能代谢苯甲醇。不知道可能发生严重不良的最小量苯甲醇(EMFLAZA口服悬液含10.45 mg苯甲醇每mL;EMFLAZA片不含苯甲醇) [见警告和注意事项(5.13)]。
幼年动物毒性数据
口服给予deflazacort(0,0.1,0.3,和1.0 mg/kg/day)至从产后天(PND)21至80天幼年大鼠导致减低体重增量和对骨骼发育不良反应(包括减低生长板细胞数和改变骨分布)和对淋巴组织(减低细胞数)。没有确定无效应剂量。此外,在中间和/或高剂量观察到神经学和神经行为异常。最低测试剂量(0.1 mg/kg/day)时血浆21-desDFZ暴露(AUC)是较低于在人中EMFLAZA(0.9 mg/kg/day)推荐剂量。
8.5 老年人使用
DMD是大都是一种儿童和年轻成年的疾病;所以,没有老年用EMFLAZA经验。
8.6 肾受损
在有轻度,中度或严重肾受损患者无需剂量调整[见临床药理学(12.3)]。
8.7 肝受损
在有轻度或中度肝受损患者中无需剂量调整[见临床药理学(12.3)]。在有严重肝受损患者中无临床经验,和对有严重肝受损患者不能提供给药建议。
10 药物过量
急性药物过量的治疗是通过立即洗胃或呕吐接着支持和对症治疗。在面对严重疾病需要连续甾体治疗对慢性药物过量,EMFLAZA的剂量可能被短暂减低,或 可能被引入隔天治疗。
11 一般描述
在EMFLAZA中活性成分是deflazacort(一种皮质激素)。皮质激素是肾上腺皮质甾体,天然存在和合成都有。Deflazacort的分子式为C25H31NO6。Deflazacort的化学名是(11β,16β)-21-(acetyloxy)11-hydroxy-2'-methyl-5'H-pregna-1,4-dieno[17,16-d]oxazole-3,20-dione,而结构式为:
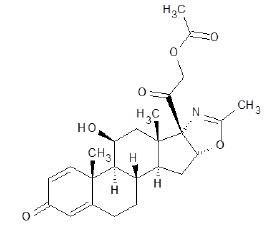
Deflazacort是白色至米色,无嗅味细粉和有一个分子量441.517。Deflazacort是易溶于醋酸和二氯甲烷和溶于甲醇和丙酮。
为口服给药可得到EMFLAZA作为即时释放片在强度6,18,30和36 mg和一种立即释放口服悬液在一个强度22.75 mg/mL。每片含deflazacort和以下无活性成分:胶体二氧化硅,一水乳糖,硬脂酸镁,和预胶化玉米淀粉。口服悬液含deflazacort和以下无活性成分:醋酸,硅酸镁铝,苯甲醇,羧甲基纤维素钠,聚山梨醇80,纯水,和山梨醇。
12 临床药理学
12.1 作用机制
Deflazacort是一个皮质激素前药,其活性代谢物,21-desDFZ,通过糖皮质激素发挥抗炎和免疫抑制效应作用。不知道deflazacort在有DMD患者发挥治疗效应的精确机制。
12.3 药代动力学
吸收
在空腹状态口服给后,用deflazacort片或悬液的中位Tmax是约1小时(范围0.25至2小时)。
食物效应:
Deflazacort片与高脂肪餐共同给药减低Cmax约30%和,相对于空腹条件给药,延迟Tmax一小时但当用AUC测量对总体全身吸收没有影响。Deflazacort片的生物利用度与口服悬液相似。Deflazacort与食物或在苹果汁中弄碎的给药不影响deflazacort吸收和生物利用度。
分布
Deflazacort的活性代谢物的蛋白结合约40%。
消除
代谢
口服给药后Deflazacort被酯酶迅速地转化为活性代谢物21-desDFZ。21-desDFZ进一步被CYP3A4代谢成几种其他无活性代谢物。
排泄
尿排泄是deflazacort消除的主要途径(约剂量的68%),而至给药后24小时消除几乎完成。21-desDFZ占在尿中消除药物的18%。
特殊人群
儿童患者
在儿童中(年龄5-11,N=16)21-desDFZ的Cmax值(几何均数,%CV)和青少年(年龄12-16,N=8) 在0.9 mg/kg deflazacort给药后天1分别为206 ng/mL(95.6%)和381 ng/mL(37.7%)。在儿童(年龄5-11,N=16) 21-desDFZ在0.9 mg/kg deflazacort的给药后天1的AUCinf(几何均数,%CV)和青少年(年龄12-16,N=8) was 400 ng·h/mL(87.5%)和655 ng·h/mL(58.1%)。
男性和女性患者
男性和女性间21-desDFZ的药代动力学无差别。
种族或民族组
高加索和非-高加索间21-desDFZ的药代动力学无差别.
有肾受损患者
在一项研究(N=16)比较有终末肾病受试者(肌酐清除率低于15 mL/min)与健康匹配对照,组间21-desDFZ暴露是相似。
有肝受损患者
在一项研究(N=16)比较有中度肝受损受试者(Child-Pugh类别B)与健康匹配对照,组间21-desDFZ暴露是相似。没有有严重肝受损患者经验。
药物相互作用研究
药物相互作用的体内评估
与单独给予deflazacort比较,一种强CYP3A4和Pgp抑制剂(克拉霉素)多次剂量后deflazacort的给予导致明显地较高21-desDFZ Cmax,AUClast,和AUCinf值。克拉霉素的给药后21-desDFZ几何均数暴露(Cmax,AUClast,和AUCinf)范围从2.3-倍至3.4-倍较高[见剂量和给药方法(2.4)]。
与单独给予deflazacort比较,一个强CYP3A4诱导剂(利福平[rifampicin])多次给药后给予deflazacort导致21-desDFZ.几何均数暴露明显地较低Cmax,AUClast,和利福平给药后21-desDFZ的AUCinf值(Cmax,AUClast,和AUCinf)是约95%较低[见药物相互作用(7.1)]。
体外药物相互作用的评估
药物-代谢酶抑制作用
21-desDFZ在浓度直至100 μM不抑制CYP1A2,2C9,2C19,3A4,UGT1A1,UGT1A4,UGT1A6,UGT1A9,或UGT2B7和对2B6,2C8,2D6,and 3A4,UGT1A3和UGT2B15表现出弱和不像临床有意义抑制作用。
药物-代谢酶诱导作用
Deflazacort在浓度直至10 μM对CYP1A2,2B6,或3A4没有致有意义诱导反应。
转运蛋白
Deflazacort和21-desDFZ两者是Pgp的底物。对BCRP 21-desDFZ不是底物。在体外deflazacort不21-desDFZ也不抑制 Pgp或BCRP。对SLC转运蛋白OATP1B1或OATP1B3 21-desDFZ不是底物,和不抑制SLC转运蛋白OATP1B1,OATP1B3,OAT1,OAT3,或OCT2。
13 非临床毒理学
13.1 癌发生,突变发生,生育力受损
癌发生
在一项已发表2-年在大鼠中致癌性研究, deflazacort的口服给药(0,0.03,0.06,0.12,0.25,0.50,或1.0 mg/kg/day)导致头部的骨肿瘤(骨肉瘤和骨瘤)在0.25 2/kg/day,最高可评价的剂量。剂量较高于0.25 mg/kg/day不可能被评价肿瘤因为生存的明显减低。
突变发生
在体外(细菌回复突变和人淋巴细胞染色体畸变)试验Deflazacort和21-desDFZ是阴性和在一项体内(大鼠微核)试验deflazacort是阴性。
生育力受损
在动物中没有用deflazacort进行生育力研究。对猴口服deflazacort给药后 (0,1.0,3.0,or 6.0 mg/kg/day)共39周或大鼠(0,0.05,0.15,or 0.5 mg/kg/day)共26周没有观察到对雄性生殖系统的影响。在猴和大鼠在最高测试剂量剂量(0.9 mg/kg/day)的人在EMFLAZA的推荐人剂量的血浆21-desDFZ暴露(AUC)分别为42和2倍。
14 临床研究
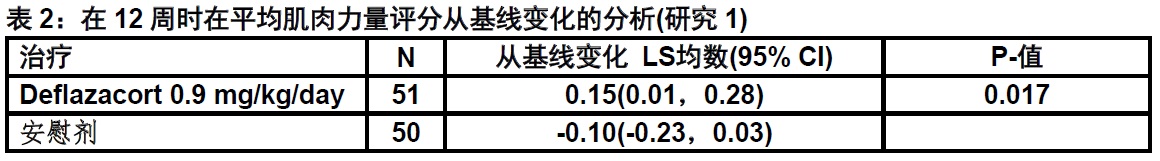
在研究1,在美国和加拿大进行一项多中心,随机化,双盲,安慰剂-对照,52-周研究确定EMFLAZA对DMD治疗的有效性。研究人群包括196例男性儿童患者5至15岁有肌营养不良蛋白基因记录的突变,软弱的发作在5岁前,和在他们疾病的有些阶段血清肌酐激酶活性至少正常上限(ULN)的10倍。患者被随机化至治疗用deflazacort(0.9或1.2 mg/kg/day),一种活性对比药,或安慰剂。治疗的12周后与安慰剂做一个比较。12周后,安慰剂患者被再次-随机化接受或deflazacort或活性对比药;所有患者继续治疗共另一个40周。治疗臂间基线特征是有可比性。
在研究1,通过评估基线和周12间的18肌肉组平均强度的变化评价疗效。各个肌肉强度利用一个修饰的医学研究理事会[Medical Research Council(MRC)]11-点评分被分级,有较高评分代表较大强度。
对deflazacort 0.9 mg/kg/day剂量组基线和周12间平均肌肉强度评分变化是显著大于安慰剂组(见表2)。
与deflazacort 0.9 mg/kg/day组比较,在12周时deflazacort 1.2 mg/kg/day组与安慰剂比较被证实一个小附加获益,但有一个不良反应更大发生率。所以,不推荐使用一个1.2 mg/kg/day EMFLAZA的剂量[见剂量和给药方法(2.1)]。
虽然不是一个预先-指定的统计分析,与安慰剂比较,deflazacort 0.9 mg/kg/day剂量组被证实在52周时存在观察到在12周时治疗效应和在12周时在观察到的1.2 mg/kg/day剂量小优点不再存在。还有对多个比较没有统计学上对照,患者功能的几个时间的结果(即,从仰卧至站的时间,爬四个阶梯的时间,和走或跑30英尺的时间) 0.9 mg/kg/day在12周时与安慰剂比较数字上有利于deflazacort。
一项附加随机化,双盲,安慰剂-对照,104-周临床试验评价deflazacort与安慰剂比较时(研究2)。研究人群包括29例男性儿童6至12岁有一个DMD诊断是通过确证的记录存在异常肌营养不良蛋白或确症的肌营养不良蛋白基因的突变。研究2中平均肌肉强度评分主要终点分析的结果(在0-5刻度上分级)在2年是统计学上不显著,是因为可能受安慰剂臂保留患者数目限制(当受试者失去步行能力时被终止试验)。虽然对多个比较没有统计学上对照,在6和12月平均肌肉强度评分,以及丧失步行平均时间,在与安慰剂比较中数字上有利于deflazacort。
16 如何供应/贮存和处置
16.1 如何供应
EMFLAZA片
● 6 mg是白色,圆在一侧凹有“6”。它们的供应如下:NDC 42998-501-01 100片瓶
● 18 mg是白色,圆一侧凹有“18”。它们供应如下:NDC 42998-502-03 30片瓶
● 30 mg是白色,卵圆一侧凹有“30”。它们供应如下:NDC 42998-503-03 30片瓶
● 36 mg是白色,卵圆一侧凹有“36”。它们被供应如下:NDC 42998-504-03 30片瓶
EMFLAZA口服悬液
● 22.75 mg/mL是一白色悬浮液。供应为13 mL在20 mL瓶包装有两个1 mL口服分配器。 NDC 42998-505-21
16.2 贮存和处置
贮存在20°C至25°C(68°F至77°F)。外出允许15°C至30°C(59°F至86°F)间。见USP控制室温。.
在首次开瓶1个月后遗弃残留的任何未使用EMFLAZA口服悬液。
17 患者咨询资料
建议患者和/或护理人员阅读FDA-批准的患者说明书如EMFLAZA口服悬液被处方(使用指导).
给药
● 警告患者和/或护理人员不要突然地停止服用EMFLAZA或没有首先与他们的卫生保健提供者核查因为有需要对逐步剂量减低以减低肾上腺功能不全的风险[见剂量和给药方法(2.2)和警告和注意事项(5.1)]。
● EMFLAZA可与食物或无食物服用。
片
● EMFLAZA片可整片服用或弄碎和与苹果汁混合后立即服用。
口服悬液
● EMFLAZA口服悬液必须每次给药前用附加的口服分配器测量充分摇动。
●EMFLAZA 口服悬液剂量可能放置在3-4 盎司的汁或奶中,彻底地混合,和立即地给药。不要用葡萄柚汁服用。
● 在首次开瓶1个月后遗弃残留的任何未使用EMFLAZA口服悬液。.
感染的风险增加
告诉患者和/或护理人员告知他们的卫生保健提供者如患者曽有最近或正在进行感染或如他们曽最近地接受一个疫苗。如患者发生发热或感染的其他体征应立即寻求医学建议。患者和/或护理人员应认识到有些感染可能潜在地是严重和致命性。
警告用皮质激素患者避免暴露至水痘或麻疹和如他们被暴露立即警戒他们的卫生保健提供者[见警告和注意事项(5.2)]。
心血管/肾功能中改变
告知患者和/或护理人员EMFLAZA可能致血压增加和水潴留。如这个发生,可能需要每天盐限制和钾补充[见警告和注意事项(5.3)]。
行为和情绪障碍
建议患者和/或护理人员关于用EMFLAZA对严重行为和情绪变化的潜能和如精神症状发生鼓励他们寻求医学关注[见警告和注意事项(5.5)]。
骨密度减低
建议患者和/或护理人员关于随长期使用EMFLAZA骨质疏松症的风险,它可能使患者易患脊椎和长骨骨折[见警告和注意事项(5.6)]。
眼效应
告知患者和/或护理人员EMFLAZA可能致白内障或青光眼和如皮质激素治疗是继续共超过6周建议监视[见警告和注意事项(5.7)]。
免疫接种
建议患者和/或护理人员不推荐给予活或或减弱疫苗。告知他们杀死或灭活疫苗可能被给予,但不能预测反应[见警告和注意事项(5.8)]。
严重皮肤皮疹
指导患者和/或护理人员在一个皮疹的首次体征时寻求医学关注[见警告和注意事项(5.9)]。
药物相互作用
某些药物与EMFLAZA可能致相互作用。建议患者和/或护理人员告知他们的卫生保健提供者患者正在服用的所有药物,包括非处方药物(例如胰岛素,阿司匹林或其他NSAIDS),膳食补充,和草药产品。告知患者和/或护理人员治疗期间可能需要另外治疗,剂量调整,和/或 特殊测试。

