批准日期:2017年2月7日;公司:Amgen Inc.;
为治疗:继发性甲状旁腺功能亢进
http://www.accessdata.fda.gov/drugsatfda_docs/label/2017/208325Orig1s000Lbledt.pdf
处方资料重点
这些重点不包括安全和有效使用PARSABIV需所有资料。请参阅PARSABIV完整处方资料
PARSABIV™(etelcalcetide)注射液,为静脉使用
美国初次批准:2017
适应证和用途
PARSABIV是一种钙敏感受体激动剂适用为:
● 继发性甲状旁腺功能亢进(HPT)在成年患者有慢性肾病(CKD)用血液透析。(1)
使用的限制: PARSABIV不推荐为这些人群中使用:患者有甲状旁腺癌,原发性甲状旁腺功能亢进,或有CKD而不用血液透析。
剂量和给药方法
● 确保校正的血清钙是处于或高于正常低限开始前,剂量增加,或再-开始。(2.1)
● 推荐开始剂量是通过静脉推注注射液5 mg给予每周三次在血液透析治疗结束时。(2.1)
● 维持剂量是个体化和被滴定调整根据甲状旁腺激素(PTH)决定和校正的血清钙反应。这个剂量范围是2.5至15 mg每周三次。(2.1)
● 这个剂量可能被增加以2.5 mg或5 mg增量不频于每4周。(2.2)
● 开始或剂量调整后1周内测量血清钙和每4周为维持。(2.2)
● 从开始或剂量调整测量后4周测量PTH。(2.2)
● 减低或暂时地终止PARSABIV,在个体有PTH水平低于目标范围。(2.2)
● 考虑减低或暂时地终止PARSABIV或使用同时治疗增加校正的血清钙在有一个校正的血清钙低于正常低限单处于或高于7.5 mg/dL低钙血症的无症状患者。(2.2)
● 终止PARSABIV和治疗低钙血症如校正的血清钙下降低于7.5 mg/dL或患者报告低钙血症症状。(2.2)
● 给药前不要混合或稀释。(2.3)
● 在冲洗后或静脉内冲洗后期间血液透析的结束时通过静脉推注注射液给入至透析环路静脉线。(2 3)
剂型和规格
● 注射液:2.5 mg/0.5 mL溶液在一个单剂量小瓶中(3)
● 注射液:5 mg/mL溶液在一个单剂量小瓶中(3)
● 注射液:10 mg/2 mL溶液在一个单剂量小瓶中(3)
禁忌证
PARSABIV是禁忌在患者对etelcalcetide或它的赋形剂的任何有已知的超敏性。(4)
警告和注意事项
● 低钙血症 有时严重。严重的低钙血症可能致皮肤感觉异常,肌痛,肌肉痉挛,癫痫,QT 延长,和室性心律失常。患者易患QT间期延长,室性心律失常,和癫痫可能处于增加风险和需要严密监视。教育患者对低钙血症的症状和建议如他们发生联系卫生保健提供者。(5.1)
● 恶化的心衰校正的血清钙中减低可能伴随充血性心衰,但是,不能完全地排除与PARSABIV一个因果相互关系。严密地监视患者对心衰的恶化的体。
● 上胃肠(GI)出血患者 对上GI出血风险因子患者可能是处于增加风险。监视患者和及时地评价和治疗任何怀疑的GI出血。(5.3)
● 可能发生无力的骨[Adynamic Bone] 如PTH水平被慢性地抑制,如PTH水平减低低于推荐的目标范围,PARSABIV的剂量应被减低或终止。(5.4)
不良反应
最常见不良反应(≥ 5%)为血钙减低,肌肉痉挛,腹泻,恶心,呕吐,头痛,低钙血症,和感觉异常。(6)
报告怀疑不良反应,联系Amgen Inc电话1-800-77-AMGEN(1-800-772-6436)或FDA电话1-800-FDA-1088或www.fda.gov/medwatch。
特殊人群中使用
哺乳:当哺乳喂养时建议不使用PARSABIV。(8 2)
完整处方资料
1 适应证和用途
PARSABIV是适用为继发性甲状旁腺功能亢进(HPT)在有慢性肾病(CKD)用血液透析成年患者中的治疗。.
使用的限制:未曽在成年患者有甲状旁腺癌,原发性甲状旁腺功能亢进,或有慢性肾病没有用血液透析研究PARSABIV和建议不推荐为这些人群中使用。
2 剂量和给药方法
2.1 推荐给药
● PARSABIV开始前,PARSABIV剂量增加,或PARSABIV治疗给药中断后再-开始确保校正的血清钙是或高于正常低限[见剂量和给药方法(2.2)和警告和注意事项(5.1)]。
● 在血液透析治疗结束时PARSABIV的推荐开始剂量是5 mg静脉(IV)推注注射液每周三次。
● PARSABIV的维持剂量是个体化和被滴定调整根据甲状旁腺激素(PTH)决定和校正的血清钙反应[见剂量和给药方法(2.2)]。维持剂量是维持PTH水平在推荐度目标范围内和校正的血清钙的正常范围内的剂量。PARSABIV的最低维持剂量是2.5 mg每周三次和PARSABIV的最高维持剂量是15 mg每周三次。
● 仅在血液透析治疗结束时给予PARSABIV。
● 如缺失一个常规地时间表的血液透析治疗,不要给予任何缺失剂量。在下一次处方剂量的血液透析治疗结束时恢复PARSABIV。如PARSABIV剂量被缺失共超过2周,在推荐开始剂量5 mg再-开始PARSABIV (或2.5 mg如该剂量是患者的最后剂量)。
2.2 监视和剂量调整
● 给药开始,剂量调整,和剂量按照表1中时间表维持期间监视校正的血清钙和PTH水平。

● 根据PTH和校正的血清钙反应滴定调整PARSABIV剂量。在维持剂量时,PTH水平应在推荐目标范围内和校正的血清钙正常范围内。
● PARSABIV的增加剂量在2.5 mg或5 mg增量在个体有校正的血清钙正常范围内和PTH水平高于推荐的目标范围根据患者的PTH水平不更频地超过每4周至最大剂量15 mg每周三次。
● 在个体有PTH水平低于目标范围,减低或暂时地终止PARSABIV给药。在个体有一个校正的血清钙低于正常低限单在或高于7.5 mg/dL无低钙血症的症状,考虑减低或暂时地终止PARSABIV或使用同时治疗增加校正的血清钙[见警告和注意事项(5.1)]。如剂量被停止,当PTH是在目标范围内和低钙血症已被校正然后在较低剂量重新-开始PARSABIV。
● 如校正的血清钙下降低于7.5 mg/dL或患者报告低钙血症的症状,停止PARSABIV和治疗低钙血症[见警告和注意事项(5.1)]。当校正的血清钙是正常限度内,低钙血症的症状已解决,和低钙血症的诱发因素已经得到解决,在一个剂量5 mg低于最后给药剂量重新开始PARSABIV. 如PARSABIV的最后给药剂量是2.5 mg或5 mg,在剂量2.5 mg重新-开始。
2.3 给药
● 给药前不要混合或稀释PARSABIV。溶液是透明和无色。给药前观察PARSABIV对颗粒物质和变色。如观察到颗粒物质或变色不要使用PARSABIV瓶。
● 在冲洗后或静脉内冲洗后期间,在血液透析治疗的结束时通过静脉推注注射液入透析环路的静脉线给予PARSABIV。
2.4 转换从西那卡塞[Cinacalcet]至PARSABIV
● 开始PARSABIV前终止西那卡塞共至少7天和开始PARSABIV治疗在一个开始剂量5 mg。PARSABIV开始前确保校正的血清钙是在或高于正常低限[见警告和注意事项(5.1)]。
3 剂型和规格
PARSABIV是一个单-剂量,透明,和无色可得到溶液如下:
● 注射液:2.5 mg/0.5 mL溶液在一个单剂量小瓶中
● 注射液:5 mg/mL溶液在一个单剂量小瓶中
● 注射液:10 mg/2 mL溶液(5 mg/mL)在一个单剂量小瓶中
4 禁忌证
超敏性
PARSABIV被禁忌在患者对etelcalcetide或其赋形剂的任何有已知的超敏性。用PARSABIV曽发生超敏性反应,包括瘙痒性皮疹,荨麻疹,和面水肿[见不良反应(6.1)]。
5 警告和注意事项
5.1 低钙血症
PARSABIV降低血清钙[见不良反应(6.1)]和可能导致低钙血症,有时严重。血清钙的显著降低可能致皮肤感觉异常,肌痛s,肌肉痉挛,癫痫,QT间隔延长和室性心律失常。
QT间隔延长和心室心律失常
在组合的安慰剂-对照研究中,更多用PARSABIV治疗患者经受在QTcF间隔一个从基线最大增加大于60 msec l(0%安慰剂相比1.2% PARSABIV)。在这些研究中,基线后透析前QTcF > 500 msec在安慰剂和PARSABIV组最大发生率分别为1.9%和4.8%[见不良反应(6.1)]。患者有先天性长QT综合证,QT间隔延长史,长QT综合证或心源性猝死的家族史,和其他情况易于QT间隔延长和心室心律失常如他们由于PARSABIV发生低钙血症可能是处于对QT间隔延长和室性心律失常增加风险。接受PARSABIV处于风险患者严密地监视校正的血清钙和QT间隔。
癫痫
在校正的血清钙显著减低可能减低对癫痫阈值。有癫痫疾病史患者如果由于PARSABIV发生低钙血症可能是处于对癫痫增加风险。在患者有癫痫疾患接受PARSABIV监视校正的血清钙。
PARSABIV与另一种口服钙敏感受体激动剂的同时给药可能导致严重的,危及生命,低钙血症。PARSABIV开始前共至少7天患者从西那卡塞转换至PARSABIV应终止西那卡塞[见剂量和给药方法(2.4)]。接受PARSABIV和同时治疗已知降低血清钙患者严密地监视校正的血清钙。
PARSABIV开始前测量校正的血清钙。患者如校正的血清钙是低于正常的低限不要开始。开始后一周内监视校正的血清钙或剂量调整和用PARSABIV治疗期间每4周[见剂量和给药方法(2.2)]。教育患者对低钙血症的症状和建议他们如他们发生联系卫生保健提供者。
如校正的血清钙下降低于正常的低限或发生低钙血症的症状,开始或增加钙补充(包括钙,含钙磷酸盐结合物,和/或维生素D甾醇类或在透析液钙浓度中增加)。可能需要PARSABIV剂量减低或PARSABIV的终止[见剂量和给药方法(2.2)]。
5.2 恶化的心衰
在用PARSABIV临床研究中,曽报道低血压,充血性心衰,和减低心肌性能的病例。在临床研究中,在PARSABIV-治疗患者2%发生心衰需要住院和安慰剂-治疗患者为1%。在校正的血清钙减低可能被伴随有充血性心衰,但是,不能完全地排除与PARSABIV一个因果相互关系。严密地监视用PARSABIV治疗患者对心衰的恶化的体征和症状。
5.3 上胃肠道出血
在临床研究中,注意到在死亡时间时两例用PARSABIV治疗患者在1253患者-年的暴露有上胃肠(GI)出血而在对照组在384患者-年的暴露在死亡时间注意到无患者有上GI出血。不知道在这些患者中GI出血的确切原因,和病例与太少不能确定是否这些病例是PARSABIV相关。
患者有对上GI出血风险因子(例如已知的胃炎,食道炎,溃疡,或严重的呕吐)而接受PARSABIV治疗可能是处于对GI出血增加风险。监视患者对伴随PARSABIV恶化的恶心和呕吐共同的GI不良反应[见不良反应(6.1)]和PARSABIV 治疗期间对GI出血和溃疡的体征和症状。及时地评价和治疗任何怀疑的GI出血。
5.4 无力的骨(Adynamic Bone)
如PTH水平慢性地被抑制可能发生无力的骨。如PTH水平减低低于推荐的目标范围,维生素D甾醇类和/或PARSABIV的剂量应被减低或治疗终止。终止后,在较低剂量恢复治疗在以维持PTH水平在目标范围[见剂量和给药方法(2.1)]。
6 不良反应
在说明书其他节更详细讨论以下不良反应:
● 低钙血症[见警告和注意事项(5.1)]
● 恶化的心衰[见警告和注意事项(5.2)]
● 上胃肠道出血[见警告和注意事项(5.3)]
● 无力的骨[见警告和注意事项(5.4)]
6.1 临床试验经验
因为临床试验是在广泛不同情况下进行的,临床试验观察到不良反应率不能与另一种药临床试验发生率直接比较而且可能不反映实践中观察到的发生率。
在表2中数据是衍生自两项安慰剂-对照临床研究在患者有慢性肾病和继发性甲状旁腺功能亢进用血液透析。数据反映503患者对PARSABIV暴露有对PARSABIV均数时间至23.6周。患者的均数年龄为约58岁,和60%患者为男性。总患者中,67%是高加索人,28%是黑种人或非洲美国人,2.6%是亚裔,1.2%为夏威夷土著或其他太平洋岛民,和1.6%被分类为其他。
表2显示在合并的安慰剂-对照研究中伴随PARSABIV的使用常见不良反应。这些不良反应用PARSABIV比用安慰剂更常见发生和用PARSABIV治疗患者被报道至少5%。
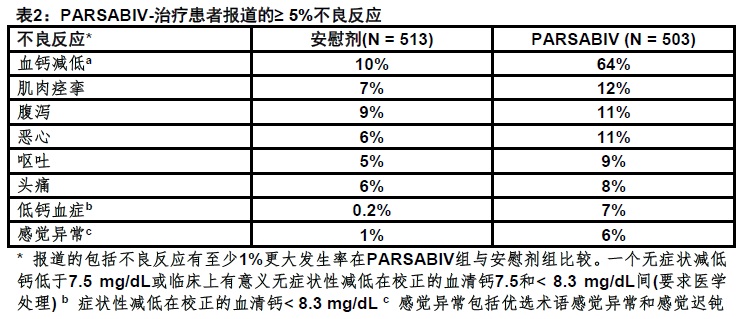
在两项安慰剂-对照临床研究伴随PARSABIV的使用其他不良反应但PARSABIV组报道在< 5%患者为:
● 高钾血症:对安慰剂和PARSABIV分别为3%和4%。
● 为心衰住院:对安慰剂和PARSABIV分别为1%和2%。
● 肌痛:对安慰剂和PARSABIV分别为0.2%和2%。
● 低磷血症:对安慰剂和PARSABIV分别为0.2%和1%。
被选定不良反应的描述
低钙血症
在组合安慰剂-对照研究中,用PARSABIV的较高比例的患者发生至少一例校正的血清钙值低于7.0 mg/dL(7.6% PARSABIV,3.1%安慰剂),低于7.5 mg/dL(27% PARSABIV,5.5%安慰剂),和低于8.3 mg/dL(79% PARSABIV,19%安慰剂)。在组合的安慰剂-对照研究,在PARSABIV组1%的患者和在安慰剂组0%患者,由于一种不良反应终止治,疗归咎于一个低校正的血清钙。
低磷血症
在组合安慰剂-对照研究中,18%的用PARSABIV治疗患者和8.2%的用安慰剂治疗患者有至少一个测得的磷水平低于正常低限(即.,2.2 mg/dl)。
QTc间隔延长继发于低钙血症
在组合安慰剂-对照研究中,在QTcF间隔更多用PARSABIV治疗患者从基线大于60 msec (0% 安慰剂相比1.2% PARSABIV)经受一个最大增加。在安慰剂和PARSABIV组基线后透析前QTcF > 500 msec患者最大发生率分别为1.9%和4.8%。
超敏性
在组合安慰剂-对照研究中,在PARSABIV组受试者与超敏性潜在相关不良反应的发生率为4.4%和在安慰剂组为3.7%。在PARSABIV组超敏性反应为瘙痒性皮疹,荨麻疹,和面水肿。
6.2 免疫原性
如用所有肽治疗药,有对免疫原性潜能。抗-药结合抗体形成的检测是高度依赖于分析的灵敏度和特异性。此外,在某个分析中观察到抗体阳性的发生率可能受几种因子影响,包括分析方法学,样品处置,采样时机,同时药物,和所患疾病。因为这些理由,比较对etelcalcetide抗体的发生率与对其他产品抗体的发生率可能是误导。
在临床研究中,7.1%(71/995)的有继发性甲状旁腺功能亢进患者用PARSABIV治疗共至6个月对结合抗-etelcalcetide抗体测试阳性。57/71有预先存在的抗-etelcalcetide抗体。没有改变的药代动力学图形,临床反应,或安全性图形是与预先存在的或发展的抗etelcalcetide抗体伴随的证据。如果怀疑抗-etelcalcetide结合抗体的形成与一个临床上有意义效应,联系Amgen电话1-800-77-AMGEN(1-800-772-6436)讨论抗体测试。
8 特殊人群中使用
8.1 妊娠
风险总结
在妊娠妇女中没有PARSABIV使用可得到的数据。在动物生殖研究中,在剂量伴随母体毒性见到效应包括低钙血症。在一项围产期研究在大鼠中在器官形成期至分娩和断奶期间给予etelcalcetide,在围产期幼畜死亡率有略微增加,分娩中延迟,和对幼畜生长短暂效应在暴露1.8倍对临床剂量15 mg每周三次人暴露。在大鼠子代中,对性成熟,神经行为,或生殖功能没有影响。在胚胎-胎儿研究中,当大鼠和兔器官形成期时被给予etelcalcetide,在暴露为临床剂量的分别2.7和7 倍暴露时观察到胎儿生长减低。
不知道对适应证人群重大出生缺陷和流产估算的背景风险。在美国一般人群中,重大出生缺陷和在临床上认可流产估算的背景风险分别是2-4%和15-20%。
数据
动物数据
在Sprague-Dawley大鼠当etelcalcetide 被给予在剂量0.75,1.5,和3 mg/kg/day通过静脉途径在器官形成期时(交配前至妊娠天17)根据AUC在暴露至1.8倍人暴露在临床剂量15 mg每周三次对胚胎-胎儿发育无影响。在新西兰兔在剂量etelcalcetide为0.375,0.75,和1.5 mg/kg通过静脉途径(妊娠天7至19),根据AUC代表至4.3倍人暴露未观察到对胚胎-胎儿发育的影响。在分开研究在较高剂量4.5 mg/kg在大鼠(妊娠天6至17)和2.25 mg/kg在兔中(妊娠天7至20),分别代表2.7-和7-倍临床暴露,伴随低钙血症,颤抖,和体重和食物耗量减低母体毒性,有胎儿生长减低。
在一项围产期发育研究,在Sprague-Dawley大鼠给予etelcalcetide在0.75,1.5,和3 mg/kg/day通过静脉途径(妊娠天7至哺乳天20),在围产期幼畜死亡率,分娩中延迟略微增加,和在3 mg/kg/day(根据AUC代表1.8-倍人暴露在临床剂量15 mg每周三次),伴随低钙血症,颤抖,和体重和食物耗量减低母体毒性,出生后生长短暂减低。在至3 mg/kg/day,根据AUC 代表暴露至1.8-倍人暴露时对性成熟,神经行为,或生殖给你无影响。
8.2 哺乳
风险总结
关于PARSABIV在人乳汁中的存在人乳汁,对哺乳喂养婴儿影响或乳汁产生的影响没有数据。在大鼠中研究显示[14C]-etelcalcetide是存在乳汁中在浓度相似于血浆。因为在哺乳喂养婴儿中对PARSABIV致不良反应潜能包括低钙血症,建议妇女当哺乳喂养时不要使用PARSABIV。
数据
在哺乳大鼠在母体暴露相似于在人临床剂量15 mg每周三次单次静脉剂量[14C]-etelcalcetide后评估乳汁中的存在。在哺乳母体暴露相似于暴露在人临床剂量时暴露时,[14C]-etelcalcetide-衍生放射性是存在于乳汁在水平相似于血浆。
8.4 儿童使用
尚未在儿童患者中确定PARSABIV的安全性和疗效。
8.5 老年人使用
在安慰剂-对照研究接受PARSABIV的503患者中,177患者(35.2%)为≥ 65岁和72患者(14%) 为 ≥ 75岁。≥ 65岁患者和较年轻患者(≥ 18和< 65岁)间未观察到安全性或疗效临床意义差别。未观察到≥ 65岁患者和较年轻患者(≥ 18和< 65岁)间etelcalcetide血浆浓度的差别。
10 药物过量
没有用PARSABIV药物过量临床经验。PARSABIV的药物过量可能导致低钙血症有或无临床 症状和可能需要治疗。尽管PARSABIV被透析清除,对PARSABIV药物过量血液透析未曽作为一种治疗研究。在药物过量的事件中,校正的血清钙应被核查和患者应被监视对低钙血症的症状,和应采取适当措施[见警告和注意事项(5.1)]。
11 一般描述
PARSABIV(etelcalcetide)是一个合成肽钙敏感受体激动剂.Etelcalcetide是一种白色至米色粉有分子式C38H73N21O10S2•xHCl(4 ≤ x ≤ 5)和一个分子量1047.5 g/mol(单一同位素的;游离碱)。它溶于水。Etelcalcetide的盐酸盐在化学上描述为N-acetyl-D-cysteinyl-S-(L-cysteine disulfide)-D-alanyl-D-arginyl-D-arginyl-D-arginylD-alanyl-D-argininamide,盐酸。
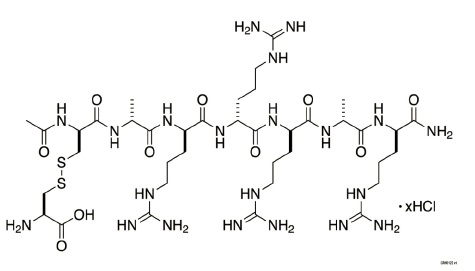
PARSABIV(etelcalcetide)注射液是在一个单剂量小瓶中供应含5 mg/mL的etelcalcetide作为一个无菌,无防腐剂,随时可用的透明和无色溶液为静脉注射液。每个PARSABIV单剂量小瓶含2.5 mg etelcalcetide(等同于2.88 mg etelcalcetide作为盐酸盐)或5 mg etelcalcetide(等同于5.77 mg etelcalcetide作为盐酸盐)或10 mg etelcalcetide(等同于11.54 mg etelcalcetide作为盐酸盐)。PARSABIV单剂量小瓶被用0.85%(w/v)氯化钠,10 mM琥珀酸制剂化,和用氢氧化钠和/或盐酸调整至pH 3.3。
12 临床药理学
12.1 作用机制
Etelcalcetide是一种拟钙剂[calcimimetic agent]别构作用地调节钙敏感受体(CaSR)。Etelcalcetide结合至CaSR和通过细胞外钙增强受体的活化。CaSR的活化对甲状旁腺主细胞减低PTH分泌。.
12.2 药效动力学
单次静脉推注给予etelcalcetide后,在给药后30分钟内PTH水平减低。在单次-剂量研究中,在PTH减低的程度和时间随增加剂量而增加。在血液透析患者中,PTH水平中减低与血浆etelcalcetide浓度相关。在PTH中减低导致在钙中和透析后磷酸盐升高的减弱。当etelcalcetide通过静脉推注每周三次给予在6-个月给药阶段期间,减低的PTH水平的影响维持自始至终。
12.3 药代动力学
Etelcalcetide的药代动力学是线性和单次(5至60 mg)和多次静脉剂量(2.5至20 mg)在有继发性甲状旁腺功能亢进需要血液透析慢性肾病患者后跨越时间无变化。Etelcalcetide静脉给药后表现出三指数衰减。根据群体药代动力学分析,在慢性肾病患者一周三次静脉给药后在每3-至6-小时血液透析阶段结束时,在给药后7-8周etelcalcetide血浆水平达到稳态有一个预测的积蓄比值3-至4-倍,和有效半衰期为3至4天。.
分布
在群体药代动力学模型中,在稳态分布容积(Vss)是约796 L。Etelcalcetide是主要地结合通过共价结合至血浆白蛋白。Etelcalcetide与血浆蛋白的非共价结合是低有一个非结合分量比值0.53。[14C]-etelcalcetide浓度血-与-血浆比值是约0.6。
消除
代谢
Etelcalcetide不被CYP450酶系代谢。Etelcalcetide在血中通过可逆性二硫化物与内源性硫醇交换被生物转化主要地与血清白蛋白形成结合物。在需要血液透析慢性肾病有继发性甲状旁腺功能亢进患者一个单次放射性标记剂量后,生物转化产物的血浆暴露是约5-倍较高于 etelcalcetide和它们浓度-时间曲线c过程与etelcalcetide平行。
排泄
在有正常肾功能患者中Etelcalcetide是被肾排泄清除,而在慢性肾病需要血液透析患者血液透析是主要消除途径。在用血液透析的慢性肾病患者,etelcalcetide被血液透析去除的清除率值值为7.66 L/hr。在有继发性甲状旁腺功能亢进需要血液透析慢性肾病患者,etelcalcetide的单次放射性标记剂量后在透析液中回收约60%f[14C]-etelcalcetide,和175天的收集期间跨越在尿和粪中组合回收约7%。
特殊人群
体重,性别,种族,和年龄的影响
群体药代动力学分析的结果表明体重(29至163 kg),性别,种族,和年龄(20至93岁)不影响etelcalcetide的药代动力学。在≥ 65岁患者和在< 65岁患者etelcalcetide的药代动力学相似。.
药物相互作用
药物相互作用的体外评估
Etelcalcetide不抑制或诱导CYP450酶系,和不是CYP450酶系的底物。Etelcalcetide不是流出和摄入转运蛋白(P-糖蛋白[Pgp],乳癌耐药蛋白[BCRP],有机阴离子转运蛋白[OAT] 1和3,有机阴离子多肽转运蛋白[OATP]1B1和1B3,有机阳离子转运蛋白[OCT] 2,和肽转运蛋白[PEPT]1和2)的底物。Etelcalcetide也不是共同转运蛋白(Pgp,BCRP,OAT1,OAT3,OATP1B1,OATP1B3,OCT2,或胆汁盐输出泵[BSEP])的一个抑制剂.
13 非临床毒理学
13.1 癌发生,突变发生,生育力受损
在Tg rasH2转基因小鼠中当etelcalcetide通过皮下途径被给予在剂量0.3,1,和3 mg/kg在雌性,和0.375,0.75,和1.5 mg/kg在雄性每天1次共26周,根据AUC代表至0.4-倍临床暴露在最大人剂量15 mg每周三次,未观察到药物相关肿瘤。当Sprague-Dawley大鼠被给予剂量在0.2,0.4,0.8,和1.6 mg/kg/day通过皮下途径共89周在雌性和92周在雄性,根据AUC接受etelcalcetide在15 mg每周三次患者实现临床暴露代表至0.4-倍临床暴露Etelcalcetide给药不产生药物相关肿瘤。.
Etelcalcetide是致突变性在某些株的细菌(Ames),但在两个体外和两个体内哺乳动物遗传毒性试验没有遗传毒性。所以,etelcalcetide被认为在人中无-遗传毒性。当etelcalcetide被给予在剂量0.75,1.5,and 3 mg/kg/day通过静脉途径至大鼠在暴露水平至1.8-倍根据AUC较高于在接受etelcalcetide在15 mg每周三次患者实现的暴露,对雄性或雌性生育力没有影响。.
14 临床研究
在有慢性肾病患者接受血液透析每周三次被评价在两项26-周,随机化,双盲,安慰剂-对照研究(研究1和研究2) PARSABIV为继发性甲状旁腺功能亢进的治疗的疗效和安全性。
PARSABIV的开始剂量为5 mg每周三次在血液透析的结束时给予。PARSABIV剂量被滴定调整每4周直至周17至一个最大剂量15 mg每周三次至靶向一个PTH水平低于或等于300 pg/mL。PARSABIV被暂时地停止如两次连续的PTH水平为低于100 pg/mL。PARSABIV的剂量不增加如PTH水平是低于或等于300 pg/mL,校正的血清钙为低于8.3 mg/dL,发生症状性低钙血症,或研究者判断不需要剂量增加。
在疗效评估时PARSABIV的平均剂量(周20至27,包括全部)为7.2 mg每周三次。有较低筛选PTH水平患者是用较低剂量与一个均数平均剂量5.7 mg,7.4 mg,和8.7 mg每周三次对患者有筛选PTH水平分别低于600 pg/mL,600至低于或等于1000 pg/mL,和大于1000 pg/mL。研究自始至终,患者被维持在用一个透析液钙浓度大于或等于2.25 meq/L。
在每项研究中,主要结局测量为在PTH水平从基线至疗效评估期有一个大于30%减低患者的比例(均数PTH水平共周20至27,包括全部)。其他结局测量为有一个均数PTH低于或等于300 pg/mL患者的比例,在PTH,校正的血清钙,和磷酸盐水平从基线变化百分数。
研究1纳入508患者(254例PARSABIV,254例安慰剂)。组间基线人口统计和疾病特征被平衡。患者的均数年龄为58岁,和57%为男性。纳入患者中,69%为白种人,28%为黑种人,2%为亚裔,和13%种族为西班牙/拉丁美洲裔。均数基线PTH水平为834.2 pg/mL,均数基线校正的血清钙为9.6 mg/dL,和纳入研究前血液透析平均时间(最小至最大)为5.5(0.1至32.2)年。66%患者有一个均数筛选PTH水平大于或等于600 pg/mL,74%患者被接受维生素D甾醇类,和84%患者接受磷酸盐结合剂。
研究2纳入515患者(255例PARSABIV,260例安慰剂)。组间基线人口统计和疾病特征被平衡。患者的均数年龄为59岁,和64%为男性。被纳入患者中,65%为白种人,28%为黑种人,4% 为亚裔,和13%种族为西班牙/拉丁美洲裔。均数基线PTH水平为848.4 pg/mL,均数基线校正的血清钙为9.7 mg/dL,和研究纳入前血液透析平均时间(最小至最大)为5.4(0.3至32.1)年。 67%患者有一个均数筛选PTH水平大于等于600 pg/mL,62%患者是接受维生素D甾醇类,和81%患者接受磷酸盐结合剂。
在两项研究中,一个显著较高比例用PARSABIV治疗患者实现一个比用安慰剂治疗患者比例大于30%减低在PTH水平从基线至疗效评估期(均数PTH水平共周20至27,包含全部)。在两项研究中,在PARSABIV臂中从基线至研究的结束观察到均数PTH,校正的血清钙,和血清磷酸盐水平中减低,而PARSABIV和安慰剂间差别是统计显著。表3中显示各个体研究结果。
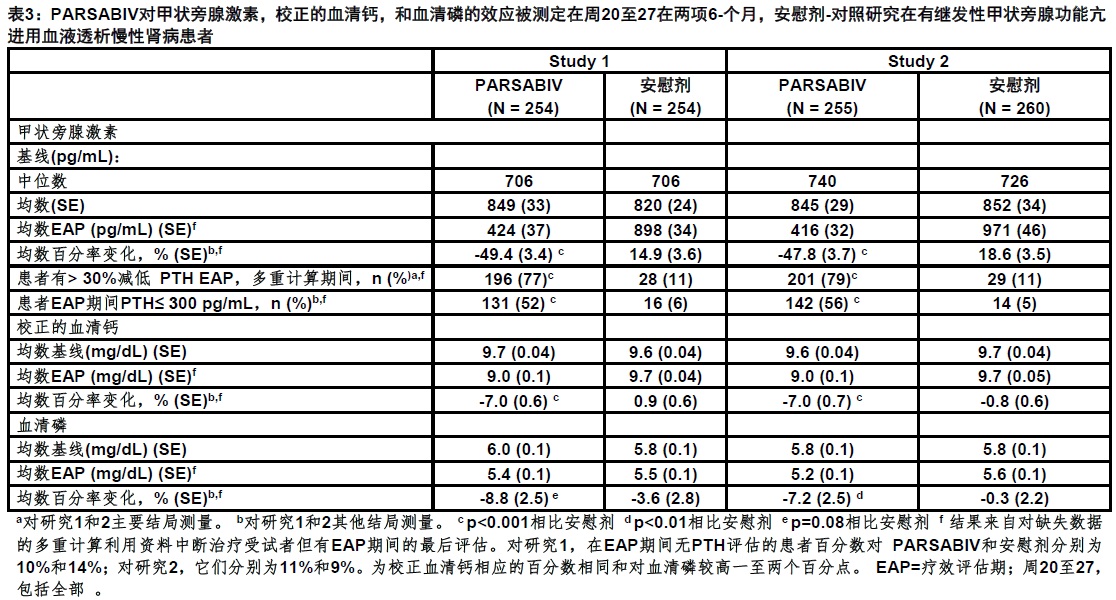
PARSABIV减低PTH水平不管基线PTH,透析的时间,患者以前是否曽用西那卡塞治疗,和患者是否接受过维生素D甾醇类。PTH水平,校正的血清钙,和血清磷酸盐中减低,在那些被选择参加两项研究延伸期的患者被维持至治疗的78周。
16 如何供应/贮存和处置
PARSABIV(etelcalcetide)注射液被供应在一个单剂量小瓶中(型I玻璃)有塞子(氟聚合物层压弹性体)和一个铝封易拉防尘盖含5 mg/mL的etelcalcetide作为一个 随时可用的透明和无色溶液在以下强度规格:

贮存
在冰箱贮存在原始纸盒在2°C至8°C(36°F至46°F)以避光保护。一旦从冰箱取出:
● 不要暴露至温度高于25°C(77°F).
● 如贮存在原始纸盒中在7天内使用。
● 如从原始纸盒中取出,在4小时内使用和不要暴露于直接阳光。
17 患者咨询资料
低钙血症
建议患者报告低钙血症的症状,包括皮肤感觉异常,肌痛,肌肉痉挛,和癫痫,至他们的卫生保健提供者[见警告和注意事项(5.1)]。
心衰
劝告有心衰患者PARSABIV的使用可能恶化他们的心衰和可能需要附加监视[见警告和注意事项(5.2)]。
上胃肠道出血
建议患者报告任何上胃肠道出血的症状至他们的卫生保健提供者[见警告和注意事项(5.3)]。
实验室监视
告知患者常规血液测试的重要性,为了监视PARSABIV治疗的安全性和疗效。
哺乳
建议使用PARSABIV妇女,当哺乳喂养时建议不要使用[见特殊人群中使用(8.2)]。

