批准日期:2016年5月27日;公司:Blue Earth Diagnostics,Ltd.
FDA的药品评价和研究中心医学影像产品部主任Libero Marzella,M.D.,Ph.D.说:“当PSA处在非常低水平时,影像测试不能确定复发前列腺癌的位置,”。“对这些患者Axumin是提供显示另一个准确影像的方法。”
http://www.accessdata.fda.gov/drugsatfda_docs/label/2016/204442Orig1s000lbl.pdf
处方资料重点
这些重点不包括安全和有效使用AXUMIN所需所有资料。请参阅AXUMIN完整处方资料。
AXUMIN(fluciclovine F 18)注射液,为静脉使用
美国初次批准:2016
适应证和用途
Axumin是一种放射性诊断剂适用为在男性根据升高的血前列腺抗原抗原(PSA)水平以前治疗后正电子发射断层扫描(PET)影像有怀疑的前列腺癌复发(1)。
剂量和给药方法
⑴使用适当的辐射安全处置措施。(2.1).
⑵从其容器无菌地抽吸Axumin和作为静脉推注注射给予370 MBq(10 mCi)(2.2).
⑶给药后3-5分钟开始影像。应从大腿-中段和至颅底进行扫描,有一个总扫描时间接近20-30 分钟。(2.4).
⑷在一名成年中伴随Axumin 370 MBq(10 mCi)被注射的活性有效(辐射吸收)剂量接近8 mSv(0.8 rem)。(2.6).
剂型和规格
注射液:透明,无色溶液一个30 mL多-剂量小瓶在校正时间和日期含335-8200 MBq/mL(9-221 mCi/mL) fluciclovine F18。(3).
禁忌证
无。(4)
警告和注意事项
用Axumin影像可能发生影像解释错误(5.1).
辐射风险:Axumin对患者的长期累计辐射暴露贡献。确保安全处置以保护患者和卫生保健工作者来自无意的辐射暴露(2.1,5.3)。
不良反应
最常见报道不良反应是注射部位疼痛,红斑,和味觉障碍(6.1)。
报告怀疑不良反应,联系Blue Earth Diagnostics,Ltd电话1-855-AXUMIN1(1-855-298-6461)或FDA电话1-800FDA-1088或www.fda.gov/medwatch
完整处方资料
1 适应证和用途
Axumin是适用为正电子发射断层根据在男性中以前治疗后升高的血前列腺抗原抗原(PSA)水平扫描(PET)有怀疑的前列腺癌复发。
2 剂量和给药方法
2.1 放射安全性-药物处置
Axumin是一个放射性药物和应用适当安全性措施处置以缩小给药期间辐射暴露[见警告和注意事项(5.3)]。当处置和给予Axumin时,使用防水手套和有效屏蔽,包括注射器屏蔽。.
2.2 推荐剂量和给药指导
推荐剂量是370 MBq(10 mCi)静脉推注给予。
● 给药前视力观察Axumin对颗粒物质和变色。如溶液含颗粒物质或变色不要使用。
● 当撤药和给予Axumin时使用无菌术和辐射屏蔽。
● 根据校正时间和日期利用一个适宜的校正仪器计算需要给予的容积。推荐的注射未稀释Axumin容积是5mL。
● Axumin可用注射用氯化钠溶液,0.9%稀释。
● 在Axumin注射后,给予无菌氯化钠注射液,0.9%静脉冲洗,以确保剂量完全输送。
● 以遵守适用的法规的安全方式遗弃任何未使用药物。
2.3 PET影像前患者准备
● PET影像前至少一天忠告患者避免任何显著运动。
● 给予Axumin前忠告患者不要吃或饮共至少4小时(除了小量水服药)。
2.4 影像采集指导原则
患者仰卧位手臂放在头上。Axumin注射完成后开始PET扫描3至5分钟。建议影像采集应从大腿中部开始和进行至颅底部。典型总扫描时间为20至30分钟间。
2.5 影像显示和解释
复发前列腺癌部位的定位典型对前列腺癌复发是根据fluciclovine F18摄取与背景组织比较。对小病变(直径小于1 cm)局部摄取大于血液池时应被考虑怀疑前列腺癌复发。对较大病变,摄取等于或大于骨髓被考虑为怀疑对前列腺癌复发。
2.6 辐射剂量学
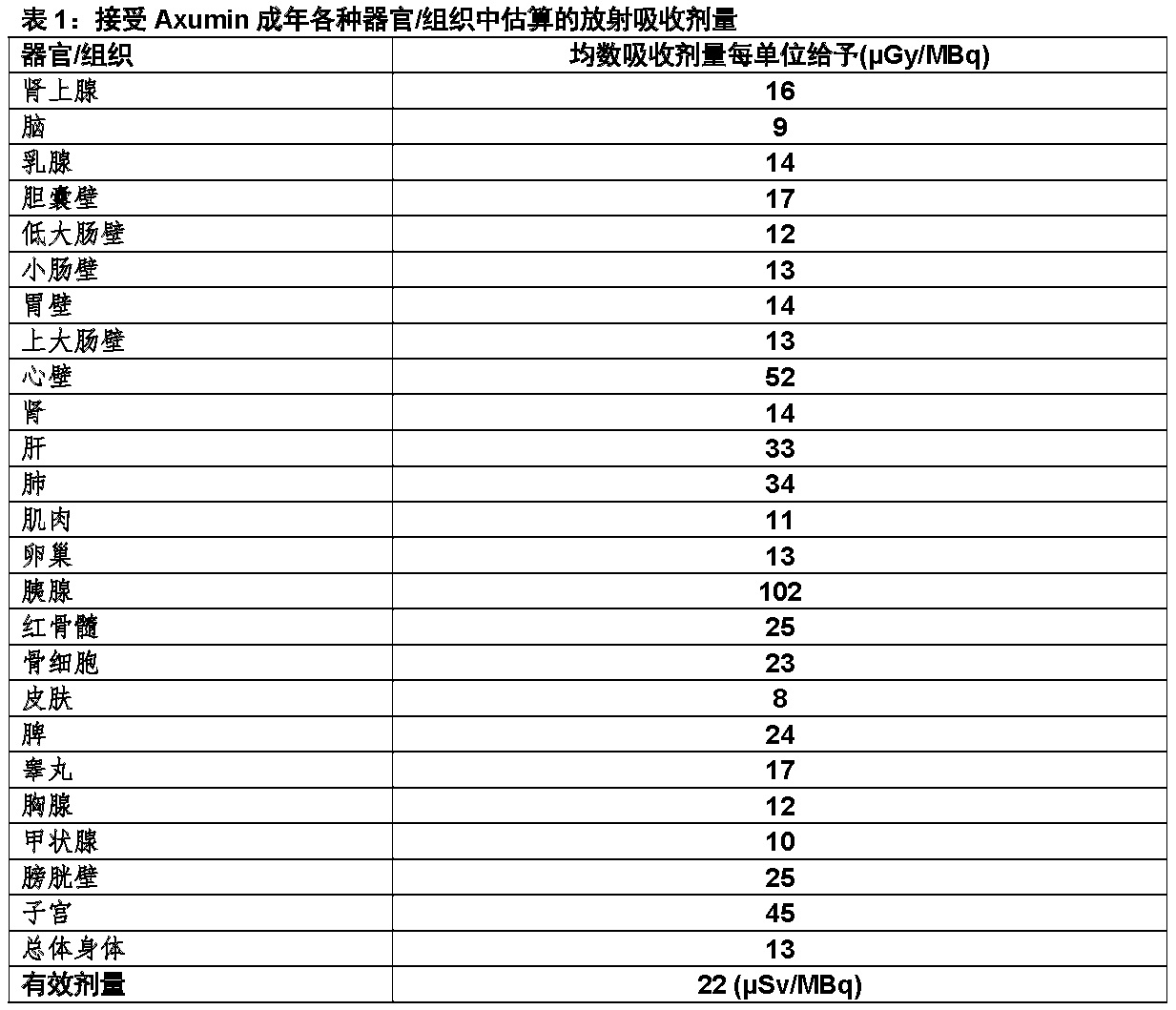
表1中显示成年患者静脉注射Axumin 估算的辐射吸收剂量。数值是利用OLINDA/EXM(器官水平内剂量评估/指数模型分析Organ Level Internal Dose Assessment/Exponential Modeling)软件从人生物分布数据计算。
来自给予推荐活性370 MBq的Axumin结果的吸收辐射有效剂量为8 mSv。对一个给予活性 370 MBq(10 mCi),最高辐射剂量幅度被输送至胰腺,心壁,和子宫壁:分别为38 mGy,19 mGy,和17 mGy。如同时进行一个CT扫描作为PET操作的一部分,对电离辐射的暴露将增加,在一个量依赖于在CT采集时所用的情况。
3 剂型和规格
注射液:作为透明,无色溶液在一个在校正时间和日期含30 mL多-剂量335至8200 MBq/mL(9至221 mCi/mL)fluciclovine F18供应。
4 禁忌证
无。
5 警告和注意事项
5.1 影像解释错误风险
用Axumin PET影像可能发生影像解释错误。一个阴性影像不能除外前列腺癌复发的存在而一个阳性影像不能确证前列腺癌复发的存在。Axumin的性能似乎受PSA水平影响[见临床研究(14)]。Fluciclovine F18摄取不是对前列腺癌特异性和可能发生在原发性前列腺癌中其他类型癌症和良性前列腺肥大。建议临床相关性,它可能评价怀疑的复发部位包括的组织病理学。
5.2 超敏性反应
在接受Axumin患者可能发生超敏性反应包括过敏性反应。应可立即得到紧急急救设备和人员。
5.3 辐射风险
Axumin使用对患者的总体长期累计辐射暴露有贡献。长期累计辐射暴露是与癌症风险增加有关联。确保安全处置以缩小对患者和卫生保健提供者的辐射暴露[见剂量和给药方法(2.1)]。
6 不良反应
临床试验经验
因为临床试验是在广泛不同情况下进行的,临床试验观察到不良反应率不能与另一种药临床试验发生率直接比较而且可能不反映实践中观察到的发生率。
对Axumin临床试验数据库包括来自877例受试者包括797例被诊断有前列腺癌男性。大多数患者接受一个单次Axumin给药,一个小数量受试者(n = 50)接受至5次药物给药。均数给予活性为370 MBq(范围,163至485 MBq)。
用Axumin临床研究期间在≤1%受试者报道不良反应。最常见不良反应为注射部位疼痛,注射部位红斑和味觉障碍。
8 在特殊人群中使用
8.1 妊娠
风险总结
Axumin是不适用为女性中使用和没有在妊娠妇女或动物使用fluciclovine F 18的不良发育结局风险的信息。
8.2 哺乳
风险总结
Axumin是不适用为女性中使用和没有在人乳汁中存在fluciclovine F 18的信息。
8.3 儿童使用
未曽确定在儿童患者中安全性和有效性。
8.4 老年人使用
在Axumin的临床研究在患者总数中,平均年龄为66岁有范围21至90岁老年受试者和较年轻受试者间未观察到在安全性或有效性总体差别。
10 药物过量
在Axumin过量情况中,鼓励患者维持水化和避免频繁地以缩小辐射暴露。
11 一般描述
11.1 化学特征
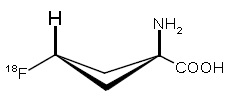
Axumin含氟18(F 18)标记的合成氨基酸类似物。Fluciclovine F18是用于PET影像的一种放射性诊断剂。化学上,fluciclovine F 18是(1r,3r)-1amino-3[18F]fluorocyclobutane-1-carboxylic acid。分子量为132.1和结构式为:
Axumin是一种无菌,无热原,透明,无色,高渗(约500 -540 mOsm/kg)注射液为静脉使用。每mL含在校正时和日期至2 µg的fluciclovine,335至8200 MBq(9至221 mCi) fluciclovine F18,和20 mg柠檬酸三钠在水中为注射。溶液还含盐酸,氢氧化钠和有一个pH为4和6间。
11.2 物理特征
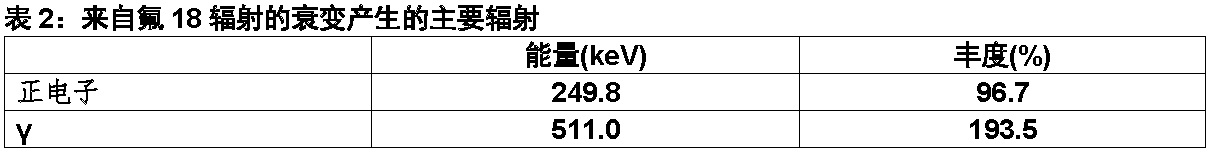
氟18(F 18)是一个回旋加速器生产的放射性核素通过发射正电子衰变(ß+衰变,96.7%)和轨道电子俘获(3.3%)至稳定氧18与一个物理半衰期109.7分。正电子可与一个电子进行湮灭[annihilation]产生两个γ[gamma]线;每个γ线的能量为511 keV(表3)。
11.3 外辐射
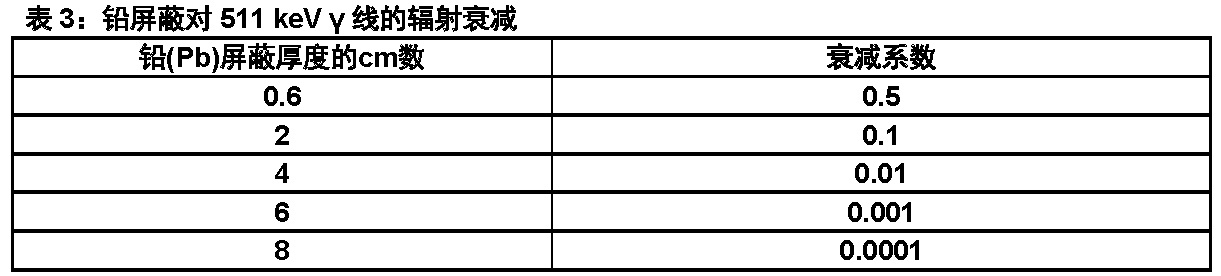
18 F的点源空气比释动能系数为3.75 x 10-17 Gy m2/(Bqs)。对F 18 γ线的第一个铅(Pb)半吸收厚度是约6 mm。表4中显示来自各种厚度铅屏蔽F 18辐射发射的相对减低的结果。使用8 cm厚度的铅板将减低辐射传输(即,暴露)因素(倍数)约10000。
12 临床药理学
12.1 作用机制
Fluciclovine F 18是一种合成氨基酸通过氨基酸转运蛋白跨越哺乳动物细胞膜转运,例如LAT-1和ASCT2,它们在前列腺癌细胞中被上调。在前列腺癌细胞与周围正常组织比较,Fluciclovine F 18被摄取程度较大。
12.2 药效动力学
静脉给药后,注射后4和10分钟间肿瘤-与-正常组织对比是最高,注射后在90分钟时在肿瘤摄取均数减低61%。
12.3 药代动力学
分布
静脉给药后,fluciclovine F18 分布至肝脏(14%的给药活性),胰腺(3%),肺(7%),红骨髓(12%)和心肌(4%)。随时间增加,fluciclovine F18分布至骨骼肌。
排泄
跨越注射后头4小时,3%的给予的放射性被排泄在尿中。跨越注射后头24小时,5%的给予放射性被排泄在尿中。
13 非临床毒理学
13.1 癌发生,突变发生,生育力受损
癌发生
在动物中未曽进行长期研究评价fluciclovine的致癌性潜能。
突变发生
在体外在细菌细胞回复突变试验和在培养哺乳动物细胞染色体畸变测试Fluciclovine没有致突变性,而在体内在大鼠中染色体断裂分析静脉注射剂量直至43 µg/kg是阴性。但是,fluciclovine F18有致突变潜能因为F18放射性同位素。.
生育力受损
没有在动物中进行研究评价在雄性或雌性中生育力受损的潜能。
14 临床研究
在两项研究在男性根治性前列腺切除术和/或放疗根据PSA水平升高有的复发前列腺癌怀疑(研究1和研究2)评价Axumin的安全性和疗效。
研究1评价105次Axumin扫描与通过前列腺床的活检和通过影像怀疑病变活检得到组织病理学比较。PET/CT影像一般地包括腹部和骨盆区。Axumin影像最初地有现场读者阅读。该影像随后地被三位盲态独立的读者阅读。表4显示在各个患者扫描的检测中复发Axumin的性能,和,特别是,分别在前列腺床内和前列腺外区。独立的阅读的结果一般地是彼此一致和确证在现场阅读的结果。
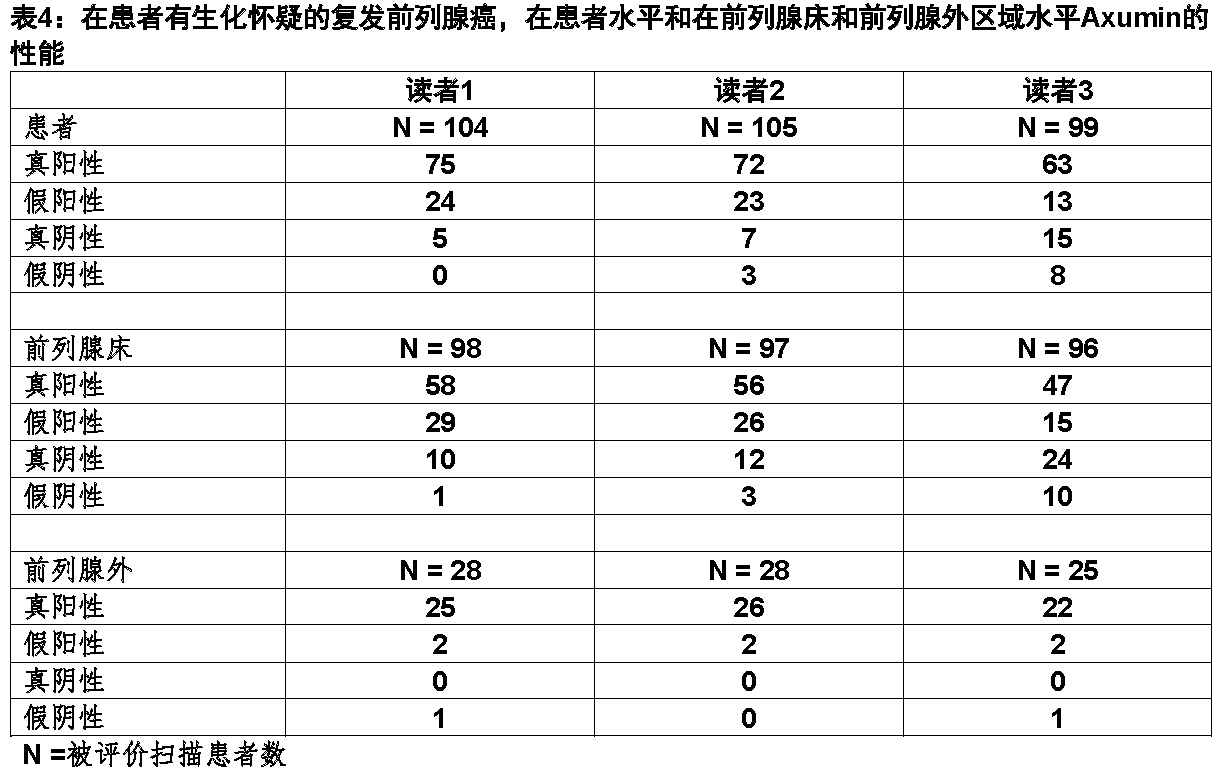
Axumin的检出率似乎是受PSA水平影响[见警告和注意事项(5.1)]。一般说来,有阴性扫描患者比有阳性扫描患者有较低的PSA值。检出率(有阳性扫描数量/总扫描)对有一个PSA值低于或等于1.78 ng/mL患者(第一个PSA四分位)为15/25,其中11为组织学上被确证为阳性。在其余三个PSA四分位,检出率为71/74,其中58为组织学上被确证。在第一个PSA四分位25患者中,有4例假阳性扫描和1例假阴性扫描。对74例有PSA水平大于1.78 ng/mL患者,有13例假阳性扫描和无假阴性扫描。
研究2评价96例在有中位PSA值1.44 ng/mL患者(四分位间距范围 = 0.78至2.8 ng/mL)Axumin和C11胆碱扫描间一致性[concordance]。C 11胆碱扫描是由现场读者阅读The Axumin扫描是由对研究1所用相同的三位盲态独立的读者阅读。Axumin和C11胆碱阅读值间一致性分别为61%,67%和77%。
16 如何供应/贮存和处置
16.1 如何供应
Axumin是作为一个透明,无色注射液在一个30 mL多-剂量玻璃小瓶含在校正时间和日期时约26 mL溶液的335-8200 MBq/mL(9-221 mCi/mL) fluciclovine F 18供应。
30 mL无菌多-剂量小瓶:NDC 69932-001-030
16.2 贮存和处置
贮存Axumin在控制室温(USP)20°C至25°C(68°F至77°F)。Axumin不含防腐剂。贮存Axumin在原始容器内在辐射屏蔽中。
这个制备物是被批准由经核管理委员会或有关监管机构的协议状态在许可下人员使用。
17 患者资讯资料
●指导患者PET扫描前至少一天避免避免显著远动。
●指导患者PET扫描前至少4小时不要吃或饮(除了为服药的小量水)。

