批准日期:2016年3月23日;公司:Teva Pharmaceutical Industries Ltd.
FDA的药品评价和研究中心中肺,过敏反应,和风湿病产品部主任Badrul Chowdhury,M.D.,Ph.D说:“卫生保健提供者和其有严重哮喘患者当疾病用他们当前哮喘治疗不能很好控制时现有另外治疗选择考虑。”
http://www.accessdata.fda.gov/drugsatfda_docs/label/2016/761033lbl.pdf
http://www.cinqair.com/pdf/PrescribingInformation.pdf
处方资料重点
这些重点不包括安全和有效使用CINQAIR所需所有资料。请参阅下文为CINQAIR的完整处方资料
CINQAIR®(reslizumab)注射液,为静脉使用
美国初次批准:2016

适应证和用途
CINQAIR是一个白介素-5拮抗剂单克隆抗体(IgG4 κ[希文])适用为18岁和以上有严重哮喘年龄和有一个嗜酸性粒细胞表型患者的添加维持治疗。(1).
使用的限制:CINQAIR是不适用为:
⑴ 其他嗜酸性情况的治疗(1)
⑵急性支气管痉挛或哮喘持续状态的缓解(1)
剂量和给药方法
• CINQAIR仅为静脉输注。不要作为静脉推注或丸注给予(2.1)
• 应由一位卫生保健专业人员准备处理过敏反应卫生保健设备情况下给予CINQAIR (2.2)
• 推荐的剂量方案是3 mg/kg每4周1次通过静脉输注历时20-50分钟(2.1)
剂型和规格
注射液:100 mg/10 mL(10 mg/mL)溶液在一次用小瓶中(3)
禁忌证
对reslizumab或其赋形剂的任何已知超敏性(4)
警告和注意事项
⑴ 恶性病:在临床研究中观察到恶性病。(5.3)
⑵ 皮质激素剂量减低:在开始用CINQAIR治疗时不要突然地终止全身或吸入皮质激素,如适当,逐渐地减低皮质激素。(5.4)
⑶ 寄生虫(蠕虫)感染:用CINQAIR治疗前治疗有预先存在蠕虫感染患者。如当接受CINQAIR时患者成为被感染和对抗蠕虫治疗不反应,终止CINQAIR直至寄生虫感染解决。(5.5)
不良反应
最常见不良反应(发生率大于或等于2%)包括口咽痛。(6.1).
报告怀疑不良反应,联系Teva制药电话1-888-483-8279或FDA电话1-800-FDA-1088或www.fda.gov/medwatch。
完全处方资料
1 适应证和用途
CINQAIR®是适用为年龄18岁和以上有一个嗜酸性粒细胞表型有严重哮喘患者的添加维持治疗[见临床研究(14)]。
使用的限制:
● CINQAIR不适用为其他嗜酸性情况的治疗。
● CINQAIR不适用为急性支气管痉挛或哮喘持续状态的缓解[见警告和注意事项(5.2)]。
2 剂量和给药方法
2.1 给药
CINQAIR仅为静脉输注。不要以静脉推注或丸注给药。推荐的剂量方案是3 mg/kg每4周1次通过历时20-50分钟静脉输注给药[见剂量和给药方法(2.2)]。
终止输注立即如患者经受一个严重全身反应,包括过敏反应[见禁忌证(4),警告和注意事项(5.1)]。
2.2 准备和给药指导
CINQAIR以溶液在一次用小瓶中提供仅为静脉输注和应由卫生保健专业人员用无菌术准备如下:
静脉输注的准备
1. 从冰箱取出CINQAIR。为缩小起泡,不要摇晃CINQAIR。
2. 给药前视力观察颗粒物质和变色。CINQAIR溶液是清澈至略微朦胧/乳白色,无色至略微黄色液体。因为CINQAIR是一种蛋白质,在溶液中可能存在蛋白质颗粒表现如半透明至白色,无定形颗粒。如存在其他外来颗粒物质不要给药。
3. 从根据推荐的基于体重剂量小瓶抽吸适当容积的CINQAIR。遗弃任何未使用部分。
4. 缓慢地分配注射器内容物至一个含50 mL的0.9%注射用氯化钠,USP输注袋以最小化CINQAIR的起泡(CINQAIR是与聚氯乙烯(PVC)或聚烯烃输注袋兼容)。轻轻地导致输液袋以混合溶液。不要摇晃。不要与其他药物混合或稀释。
5. 制备后立即给药。如不立即使用,在冰箱内在2°C至8°C(36°F至46°F)贮存稀释好的CINQAIR或在室温至25ºC(77ºF),避光保护,共至16小时。CINQAIR的准备和给药间时间不应超过16小时。
给药指导
1. 应在医疗环境由一位准备处理过敏反应卫生保健专业人员给予CINQAIR[见警告和注意事项(5.1)]。
2. 如药前冰箱保存,允许稀释好的CINQAIR溶液达到室温。
3. 使用一个在线的输注组件,低蛋白质结合过滤器(孔大小0.2微米)。CINQAIR与聚醚砜(PES),聚偏氟乙烯(PVDF),尼龙,和醋酸纤维素在线输注过滤器兼容。.
4. 静脉历时20–50分钟阶段输注稀释的CINQAIR溶液。时间依赖于可依赖输注总体积基于患者体重而变化。
5. 不要CINQAIR同时地在相同静脉线与其他药物输注。未曽进行物理或生化兼容性研究以评价CINQAIR与其他药物的共同给药。
6. 输注过程观察患者和输注后共时间阶段。用0.9% 注射用氯化钠,USP冲洗静脉给药组件以确定所有CINQAIR已被给予。
3 剂型和规格
注射液:100 mg/10 mL(10 mg/mL),清澈至略微朦胧/乳白色,无色至略微黄色溶液在一次用小瓶中。
4 禁忌证
对reslizumab或其赋形剂的任何已知超敏性患者禁忌CINQAIR [见警告和注意事项(5.1)]。
5 警告和注意事项
5.1 过敏反应
在安慰剂-对照临床研究在0.3%的哮喘患者报道对CINQAIR过敏反应[见不良反应(6.1)]。在CINQAIR输注期间或完成20分钟内观察到这些事件和早如第二剂CINQAIR报道。表现包括呼吸困难,氧饱和度减低,喘息,呕吐,和涉及皮肤和粘膜,包括荨麻疹。在所有3病例,CINQAIR被终止。
过敏反应可能是危及生命。CINQAIR应在一个医疗环境应由一位准备处理过敏反应卫生保健专业人员给药。如严重全身性反应,发生包括过敏反应CINQAIR给药后患者应被观察共适当时间阶段,立即停止CINQAIR给药和提供适当医学治疗。出院前,告知患者过敏反应的体征和症状和指导他们如症状出现立即寻求医疗护理。如患者经受过敏反应体征或症状永久终止CINQAIR使用[见禁忌证(4)].
5.2 急性哮喘症状或恶化疾病
CINQAIR不应被用于治疗急性哮喘症状或急性加重。不要使用CINQAIR治疗急性支气管痉挛或哮喘持续状态。如患者的哮喘用CINQAIR治疗的开始后仍未控制或恶化患者应寻求寻求医疗建议。
5.3 恶性病
在安慰剂-对照临床研究中,6/1028例(0.6%)患者接受3 mg/kg CINQAIR报道有至少1个恶性肿瘤与之比较在安慰剂组2/730例(0.3%)患者。在CINQAIR-治疗患者观察到恶性病性质were 各种各样和无 无任何特定组织类型集聚。恶性病的多数是暴露至CINQAIR小于6个月内被诊断。
5.4 皮质激素剂量的减低
未曽进行临床研究给予CINQAIR后评估维持皮质激素剂量的减低。在开始用CINQAIR治疗时不要突然地终止全身或吸入皮质激素。如是当时皮质激素剂量中减低,应被逐步和在医生监督下进行。皮质激素剂量中减低可能伴随全身撤药症状和/或揭露以前全身皮质类固醇治疗抑制的条件。
5.5 寄生虫(蠕虫)感染
对有些蠕虫感染免疫学反应中可能涉及嗜酸性。在临床研究中排除有已知寄生虫感染患者参加。不知道CINQAIR是否将对寄生虫感染免疫学反应影响。CINQAIR开始前有预先存在蠕虫感染治疗患者。当接受用CINQAIR治疗患者如成为感染和对抗-蠕虫治疗不反应,终止用CINQAIR治疗直至感染解决。.
6 不良反应
在说明书其他节中讨论以下不良反应:
● 过敏反应[见警告和注意事项(5.1)]
● 恶性病[见警告和注意事项(5.3)]
6.1 临床试验经验
因为临床试验是在广泛不同情况下进行,在某个药物临床试验中观察到的不良反应率不能与另外药物在临床试验中率直接比较和可能不反映在临床实践观察到的发生率。
总共,2195例受试者接受至少1剂CINQAIR。下面描述数据反映暴露于CINQAIR在1611例有哮喘患者,包括1120例暴露共至16周,1006例暴露共 6个月,759例暴露共1年,和249例暴露共较长于2年。
上面对CINQAIR参比的安全性暴露是衍生自安慰剂-对照研究时间范围从15至52周(CINQAIR 0.3 mg/kg和3 mg/kg[n=1131]和安慰剂[n=730])和480新CINQAIR 3 mg/kg暴露(以前用安慰剂)来自一项单个开放延伸研究(n=1051)。而一个较低剂量的CINQAIR 0.3 mg/kg(n=103)是包括在一项临床试验,3 mg/kg是唯一推荐剂量[见剂量和给药方法(2.1)]。1611例患者中,1596接受3 mg/kg dose,1028例其中是安慰剂-对照研究。在安慰剂-对照哮喘研究,被研究人群为12至76岁,62%女性,和73%白种人。白种人受试者年龄12至17岁被包括在这些试验,CINQAIR 是没有被批准在这个年龄组中使用[见在特殊人群中使用(8.4)]。
在安慰剂-对照研究发生在多于1例受试者和用CINQAIR治疗受试者(n=1131) 比安慰剂(n=730)百分率较大严重不良反应包括过敏反应(分别3例受试者相比0例受试者)。经受过敏反应3例受试者都从临床研究终止[见警告和注意事项(5.1)].
用CINQAIR治疗患者安慰剂恶性病也更常见地发生(分别0.6%和0.3%)[见警告和注意事项(5.3)]。
不良反应发生率发生在大于或等于2%和比安慰剂组更常见包括1事件t:口咽痛(2.6%相比2.2%)。CPK升高和肌肉-相关不良反应升高的基线肌酸磷酸激酶(CPK)为更频在患者随机化至CINQAIR(14%)相比安慰剂(9%)。在有正常基线CPK值患者相比安慰剂(18%)用CINQAIR(20%)常规实验室评估期间观察到更频短暂的CPK升高。CPK升高 >10 x ULN,不管基线CPK值,在CINQAIR组为0.8%与之比较在安慰剂组为0.4%。CPK升高 >10 x ULN 为无症状和不导致治疗终止。在CINQAIR 3 mg/kg组患者报道的肌痛为1%(10/1028),与之比较在安慰剂组为0.5%(4/730)患者。在输注天,用3 mg/kg CINQAIR治疗患者和安慰剂分别报道肌肉骨骼不良反应为2.2%和1.5%。这些反应包括(但不限于)肌肉骨骼胸痛,颈痛,肌肉痉挛,肢体疼痛,肌肉疲乏,和肌肉骨骼疼痛。
6.2 免疫原性
如同所有治疗性蛋白,对免疫原性有潜能。在安慰剂-对照研究,在53/983例(5.4%) CINQAIR-治疗患者(3 mg/kg)发生一个治疗-出现抗-reslizumab抗体反应。在长期,开发研究,在49/1014例(4.8%)CINQAIR-治疗(3 mg/kg)哮喘患者历时36个月被检测到治疗-出现抗-reslizumab抗体。抗体反应是低滴度和往往短暂。中和抗体和产生-特异性IgE抗体是未评价。抗体对CINQAIR的临床药代动力学,药效动力学,临床安全性没有可检测到的影响[见临床药理学(12.2)]。
数据反映在特异性分析中患者测试结果对reslizumab抗体阳性百分率。抗体反应观察发生率是高度依赖于几种因子,包括分析灵敏度和特异性,分析方法学,样品处置,采样时间,同时药物,和所患疾病。因为这些理由,比较对reslizumab抗体的发生率与对其他产品抗体发生率可能是误导。
7 药物相互作用
未用CINQAIR进行正式的临床药物相互作用研究。
8 在特殊人群中使用
8.1 妊娠
风险总结
来自临床试验妊娠暴露数据是不充分不能告知对药物关联风险。单克隆抗体,例如reslizumab,被以线性方式跨越胎盘转运当妊娠进展;因此,可能在妊娠的第二和第三个三个月期间对胎儿的潜在影响较大。Reslizumab有一个长半衰期[见临床药理学(12.3)]。这应被考虑。在动物生殖研究中,在器官形成期时对妊娠小鼠和兔静脉给予reslizumab在剂量在小鼠暴露至在最大推荐人剂量(MRHD)暴露至约6倍和在兔在MRHD暴露约17倍时没有产生胚胎-胎儿不利发育影响的证据[见数据]。
不知道在适应证人群中主要出生缺陷和流产的估算背景风险。在美国一般人群中,主要出生缺陷和在临床上认可妊娠中估算的背景风险分别是2至4%和15至20%。
临床考虑
疾病-关联母体和/或胚胎-胎儿风险
在有差地或中度地控制哮喘妇女中,证据显示在母亲和早熟的,低出生体重,和在对受孕年龄小新生儿中先兆子痫[preeclampsia]的风险增加。在妊娠妇女应严密监视哮喘控制的水平和需要时调整治疗以维持最优控制.
数据
动物数据
在2项分开的胚胎-胎儿发育研究,妊娠小鼠和兔在器官形成阶段时接受一个单次reslizumab 剂量在2,10,和50 mg/kg(在AUC基础上在小鼠中在MRHD时暴露达到0.4,1.5,和6倍和在兔中在mg/kg基础上为MRHD暴露达到0.67,3.3,和17倍)。在小鼠或兔中Reslizumab是没有致畸胎性。曽报道在白介素-5(IL-5)缺陷小鼠曽报道一般地相对于野生型小鼠胚胎-胎儿的发育相对地不受影响。
在一项围产期发育研究中,妊娠的CD-1小鼠在器官形成期在怀孕第6和18天和在产后第14天接受reslizumab 10或50 mg/kg(在AUC基础上在达到MRHD暴露1.5和6倍)。Reslizumab对胎儿发育直至出生后约4个月没有任何影响。Reslizumab跨越妊娠小鼠的胎盘。产后第14天幼畜中血清浓度是母兽(双亲雌性小鼠)血清浓度约6-8%。
8.2 哺乳
风险总结
不知道reslizumab是否存在人乳汁中,和不知道reslizumab对哺乳喂养婴儿和对乳汁生产的影响。但是,人IgG是已知存在于人乳汁中。Reslizumab是存在于妊娠期间给药后哺乳小鼠的乳汁中[见数据]。哺乳喂养的发育和健康获益应与母亲对CINQAIR的临床需求和哺乳喂养儿童来自CINQAIR或母体所患情况任何潜在不良影响一起被考虑。
数据
妊娠期间在怀孕第6和18天和在产后第14天接受reslizumab在10或50 mg/kg(在AUC基础上达到MRHD暴露的1.5和6倍),Reslizumab被排泄在哺乳CD-1小鼠的乳汁中,Reslizumab在乳汁中的水平约是母体血清浓度的5-7%。
8.4 儿童使用
CINQAIR是不适用为在低于18岁儿童患者使用。尚未确定在儿童患者(年龄17岁和年轻人)的安全性和有效性。在两项52-周加强研究和一项16-周肺功能研究在39例年龄12至低于18岁有哮喘患者中评价CINQAIR。在加强研究中,患者被要求有至少1次哮喘加重研究进入前年中需要全身皮质激素使用。在这些研究中,在青少年用CINQAIR治疗患者哮喘加重率是比安慰剂较高(CINQAIR n=14,发生率2.86,95% CI[1.02至8.09]和安慰剂n=11,发生率1.37,95% CI[0.57至3.28]:发生率比值2.09,95% CI[0.82至5.36])。
8.5 老年人使用
在两项52-周加强研究和两项16-周肺功能研究,在122例年龄65岁和以上有哮喘患者中评价CINQAIR。这些患者和年轻人患者间未观察到安全性和有效性中总体差别,根据可得到的数据,在老年患者中无需对CINQAIR剂量调整。
10 药物过量
在临床试验曽静脉地给予受试者单剂量至732 mg无剂量-相关毒性证据。对一个用CINQAIR过量没有特异性治疗。如发生过量,患者应被支持地治疗与需要时适当监视。
11 一般描述
CINQAIR(reslizumab)是一个人源化白介素-5拮抗剂单克隆抗体(IgG4κ)。Reslizumab是通过重组DNA技术在鼠类骨髓瘤非-分泌0(NS0)细胞生产。Reslizumab有一个分子量约147 kDa。CINQAIR是一种无菌,无防腐剂,清澈至略微朦胧/乳白色,无色至略微黄色溶液(注射液)为静脉输注。因为CINQAIR是一种蛋白质,溶液中可能存在蛋白质颗粒表现为半透明至白色,无定形颗粒。每个一次用小瓶在10 mL含100 mg reslizumab。每mL含10 mg的reslizumab,冰醋酸(0.12 mg),三水乙酸钠(2.45 mg),和蔗糖(70 mg),有一个pH为5.5。
12 临床药理学
12.1 作用原理
Reslizumab是一种白介素-5拮抗剂(IgG4,k[希文])。IL-5 是负责嗜酸性生长和分化,招募,活化,和生存的主要细胞因子。Reslizumab结合至IL-5有一个解离常数81 pM,通过阻断它结合至嗜酸性表面上表达的IL-5受体复合物的α链抑制IL-5生物活性。炎症是哮喘发病机制中一个重要组分。在炎症中涉及多种细胞类型(如,肥大细胞,嗜酸性,嗜中性,巨噬细胞,淋巴细胞)和介质(如,组织胺,类花生酸[eicosanoids],白三烯[leukotrienes],细胞因子)。Reslizumab,通过抑制IL-5信号,减低嗜酸性的生产和生存;但是,尚未最终确立reslizumab在哮喘中作用机制。
12.2 药效动力学
在用CINQAIR 3 mg/kg临床研究中,在第一次剂量后观察到血嗜酸性计数中减低和维持至治疗的52周与无快速耐受体征。嗜酸性计数均数为696细胞/µL(n=245)和在基线624细胞/µL(n=244),和为55细胞/µL(92%减低,n=212)和496细胞/µL(21%减低,嗜酸性减低是明显在2-3天评估有血嗜酸性计数一个亚组患者:对CINQAIR(n=35)和安慰剂(n=32)分别220细胞/µL和610/µL。CINQAIR末次剂量后约120天在90-天随访评估完成CINQAIR-治疗患者嗜酸性返回趋向基线(n=35,480细胞/µL)。
血嗜酸性的减低是与reslizumab血清水平相关,即,血嗜酸性的较大减低是观察到在有较高血清reslizumab浓度受试者。
治疗-出现抗-reslizumab抗体不干扰被reslizumab影响有血嗜酸性减低。
12.3 药代动力学
在健康成年(n=130),在有哮喘患者(n=438),和在其他患者群(n=236)确定reslizumab的药代动力学(PK)的特征。跨越这些人群reslizumab的PK特征相似。在峰和总体暴露个体间变异性是约20-30%。
典型地是在输注结束时观察到峰血清浓度。血清reslizumab浓度一般地以双相方式从峰下降。在多次给药后,reslizumab血清浓度积蓄约1.5至1.9-f倍。全身暴露至reslizumab似乎不受治疗出现的抗-reslizumab抗体存在的影响。
分布
Reslizumab有一个分布容积约5立升。提示分布至血管外组织小。
代谢
与其他单克隆抗体相似,reslizumab是通过酶蛋白水解至小肽和氨基酸。因为reslizumab 结合至可溶性靶点,预计它不进行通过靶点-介导清除。
消除
Reslizumab清除率是约7 mL/hour。Reslizumab有一个半衰期约2天。
特殊人群
年龄,种族,和性别
群体PK分析显示年龄,种族,或性别对reslizumab的PK无显著影响。
肝受损
未进行临床研究评估肝受损对reslizumab的PK的影响。群体PK分析结果表明有正常肝功能测试总胆红素低于或等于ULN和谷草转氨酶[AST]低于或等于ULN)和轻度增加肝功能测试(总胆红素ULN以上和低于或等于1.5-倍ULN或AST大于ULN和总胆红素低于或等于ULN)患者间reslizumab的PK中无显著差别。
肾受损
未曽进行临床研究评估肾受损对reslizumab PK的影响。群体PK分析结果表明有正常肾功能(估算肾小球滤过率[eGFR] 大于或等于90 mL/min/1.73 m2),轻度肾受损(eGFR 60-89 mL/min/1.73 m2),和中度肾受损(eGFR 30-59 mL/min/1.73 m2)患者间reslizumab的PK中无显著差别。
药物相互作用
体外数据表明IL-5和reslizumab是不可能影响CYP1A2,2B6,或3A4酶活性。
未进行用reslizumab正式临床药物相互作用研究。群体PK分析表明或白三烯拮抗剂或皮质激素的同时使用不影响reslizumab的PK。
13 非临床毒理学
13.1 癌发生,突变发生,生育力受损
在一项6-个月生物检定中,静脉给予reslizumab每2周1次共连续26周(总共14剂)至Tg.rasH2 小鼠在剂量至516 mg/kg/剂。无致癌性证据。
用动物模型发表的文献提示IL-5和嗜酸性是在肿瘤发生部位早期炎症反应的一部分和可促进肿瘤排斥。但是,其他报告表明嗜酸性浸润至肿瘤可能促进肿瘤生长。因此,在人中来自对IL-5抗体例如reslizumab恶性病风险是不知道。
在一项生育力研究,对小鼠双亲reslizumab的给予在剂量至50 mg/kg(在AUC基础上月人MRHD暴露的6倍)对雄性或雌性交配或生育力无影响。
14 临床研究
对CINQAIR 3 mg/kg(每4周给药1次)哮喘发展计划包括4项随机化,双盲,安慰剂-对照研究(研究I-IV)时间16至52周涉及981例12岁和以上患者。而患者年龄12至17岁被包括在这些试验中。CINQAIR是没有被批准在这个年龄组中使用[见在特殊人群中使用(8.4)]。所有受试者继续他们的背景哮喘治疗研究时间自始至终。
研究I和II
研究I和II是52-周研究在953例有哮喘患者需要有一个血属酸性细胞计数至少400/µL(3至4周给药内),和至少1次哮喘加重需要使用全身皮质激素历时过去12个月。患者的多数(82%)在基线时是用中位-高剂量吸入皮质激素加一个长-效作用β激动剂(ICS/LABA)。维持口服皮质激素(OCS)(直至10 mg的泼尼松[prednisone]每天或当量)被允许;106例(11%)患者为在基线时用OCS,CINQAIR 3 mg/kg给予每4周1次共总共13剂是评价与用安慰剂比较。
研究III
研究III为一项16-周研究在315例患者被要求有一个血属酸性细胞计数至少400/µL在筛选时(给药3至4周给药内),不允许维持OCS。CINQAIR 3 mg/kg或0.3 mg/kg给予每4周1次共总共4剂与安慰剂比较评价。而被研究2剂CINQAIR,CINQAIR 3 mg/kg为仅有的推荐剂量[见剂量和给药方法(2.1)]。
研究IV
研究IV为一项16-周研究在496例患者对基线血属酸性细胞水平无选定(约80%患者有一个筛选[3至4周给药内]血属酸性细胞计数低于400/µL)。不允许维持OCS。CINQAIR 3 mg/kg 给予每4周1次共总共4剂与安慰剂比较评价。
表1中提供这些4项研究人口统计和基线特征。
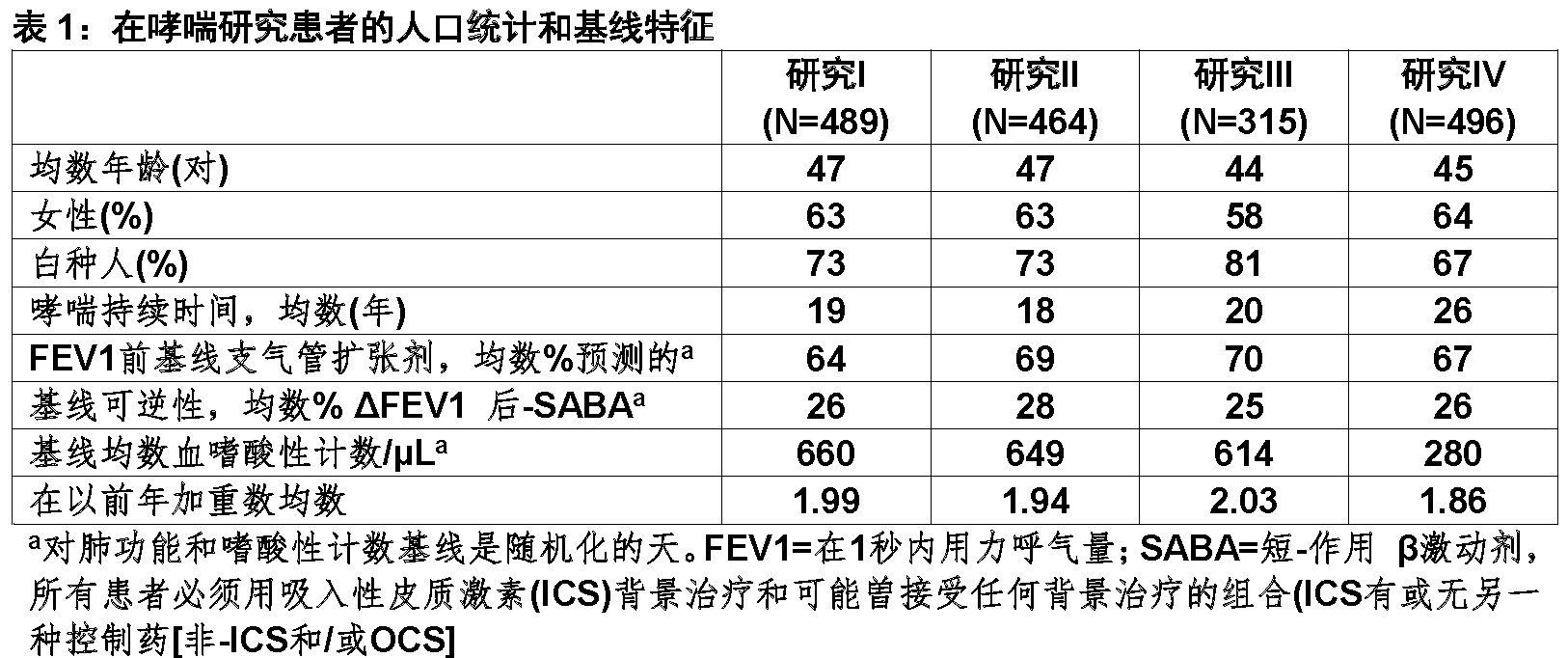
加重
对研究I和II主要终点为在52-周治疗阶段期间对每例患者哮喘加重频数。哮喘加重被定义为至少1次哮喘需要以下医学干预的恶化:
1) 或使用一次全身性皮质激素,或吸入皮质激素[ICS]增加 ≥ 2-倍使用共3或更多天,和/或
2) 哮喘-相关紧急治疗包括以下至少之一:计划外访问他们卫生保健专业人员对喷雾器治疗或其他紧急治疗预防哮喘症状的恶化;访问急诊室为哮喘-相关治疗;或一个哮喘-相关住院。
医学干预曾被至少有以下之一佐证:1) 1秒钟内用力呼气量(FEV1)从基线减低20%或更多,2) 在2连续天呼气峰流速从基线降低(PEFR)by 30%或更多,或3) 每次医生评价事件症状恶化或其他临床体征。
在研究I和II中,患者接受CINQAIR 3 mg/kg给予每4周1次在所有哮喘加重率与安慰剂比较有显著减轻(表2)。
要求使用全身皮质激素的加重(如,OCS)以及用CINQAIR 3 mg/kg加重导致住院或访问急诊室是各减少。
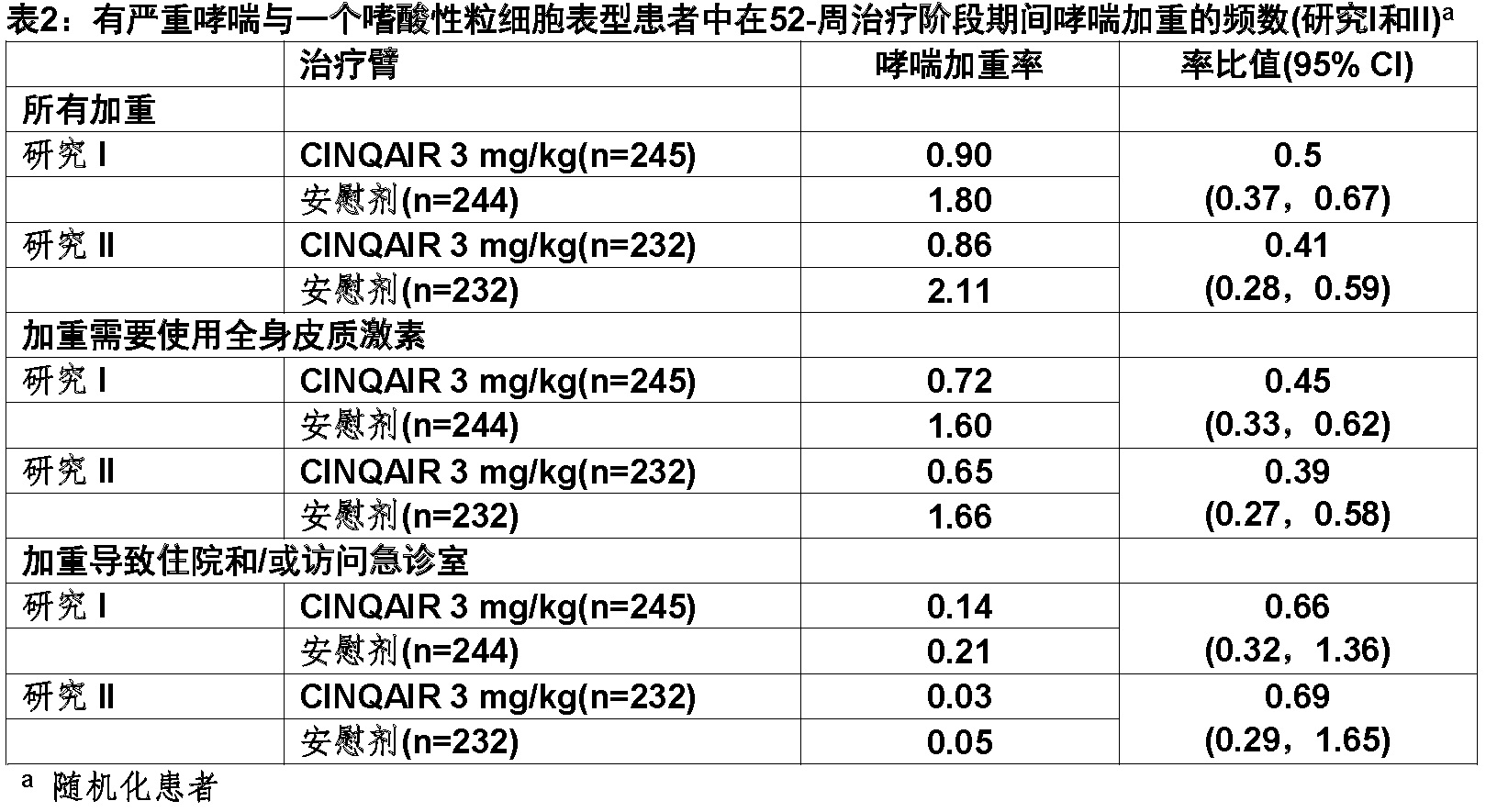
在研究I和II中在CINQAIR 3 mg/kg组没有经历52周治疗阶段期间哮喘加重患者的比例较高 (分别62%和75%)与安慰剂组(分别46%和55%)比较。
在I和II两项研究,接受CINQAIR 3 mg/kg组与安慰剂组比较加重为显著较长。研究II一项代表性显示相似结果。
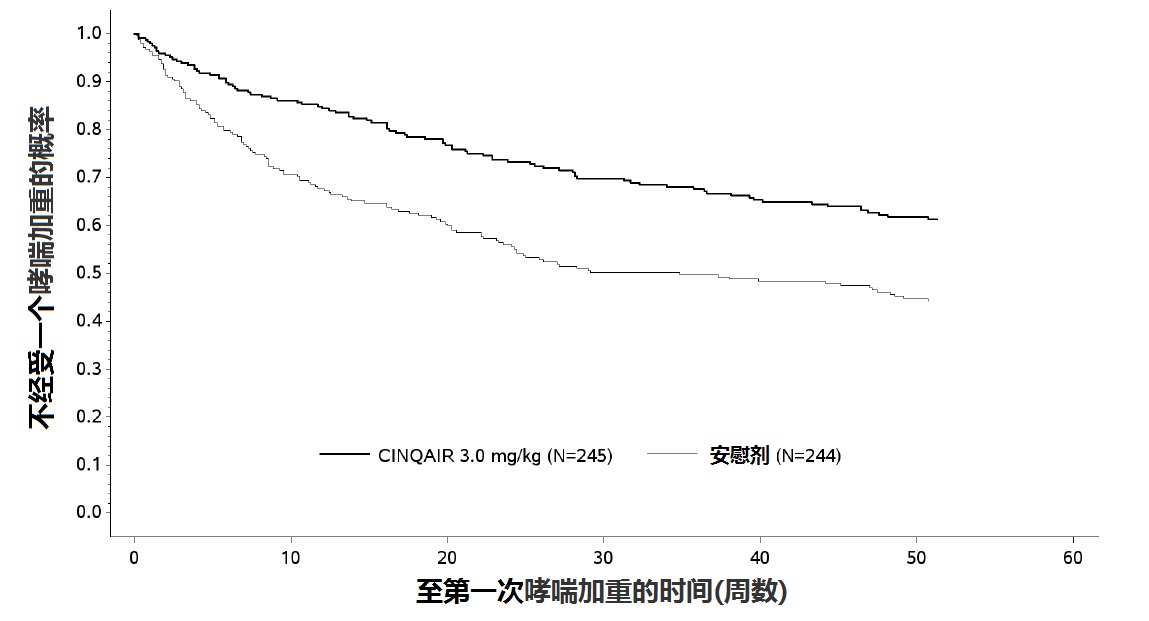
图1:在有一种嗜酸性粒细胞表型有严重哮喘患者按治疗组至第一次哮喘加重时间(研究I)。
肺功能
在所有4项研究(表3)评价相对于安慰剂CINQAIR 3 mg/kg给予每4周1次对FEV1历时变化的影响。在16-周肺功能研究:研究III(图2)和研究IVFEV1是主要疗效终点。
研究III还研究一个较低剂量,CINQAIR 0.3 mg/kg,它产生显著但在FEV1和血嗜酸性细胞减低与用3 mg/kg剂量比较数字上较小变化。而研究2个剂量的CINQAIR,CINQAIR 3 mg/kg是仅有的推荐剂量[见剂量和给药方法(2.1)].
研究IV为仅有研究测试CINQAIR 3 mg/kg在对血嗜酸性细胞未经选择的哮喘患者(给药前测量3至4周)治疗效应的关联(即,在周16CINQAIR和安慰剂间FEV1变化中差别)和未观察基线血嗜酸性细胞。

研究I和II和维持至第52周第一次剂量后4周时观察到FEV1中改善,
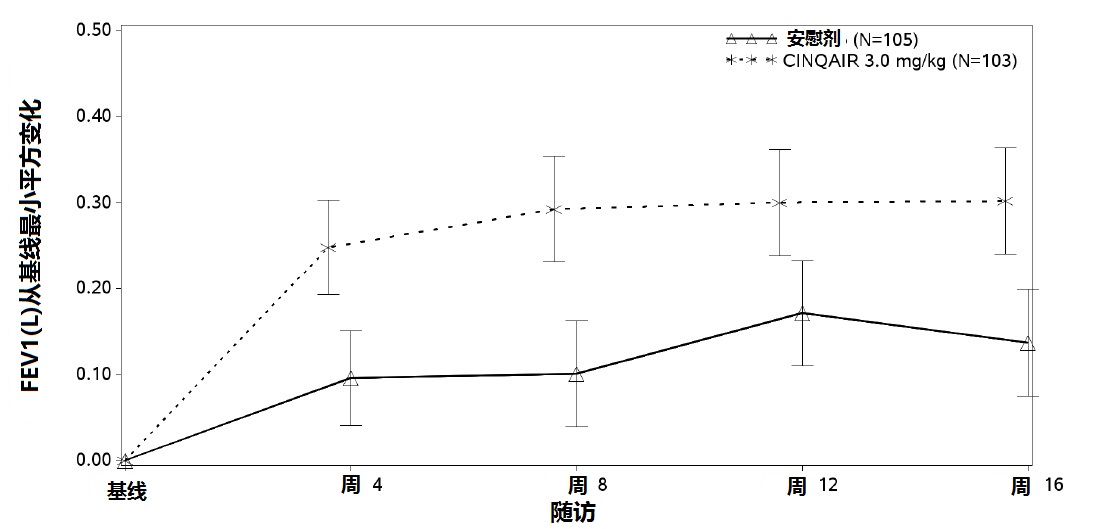
图 2:嗜酸性粒细胞表型有严重哮喘患者FEV1从基线的均数变化(研究III)
研究I,II,和III评估哮喘控制问卷-7(ACQ-7)和哮喘生活质量问卷. 反应者率对两种测量历时16周阈值定义为评分0.5或以上为改善。
● 对ACQ-7,对随机化至CINQAIR相比安慰剂患者反应者率对研究I是69%相比65%,对研究II 70%相比58%,和对研究III是64%相比58%。
● 对AQLQ,对随机化至CINQAIR相比安慰剂患者反应者率对研究I为66%相比58%,对研究II是67%相比55%,和对研究III是64%相比48%。
16 如何供应/贮存和处置
CINQAIR(reslizumab)注射液,100 mg/10 mL(10 mg/mL),以无防腐剂,无菌,透明至略微朦胧/乳白色,无色至略微黄色溶液在一次用小瓶中供应。
可得到以下包装规格:
● NDC 59310-610-31:100 mg/10 mL(10 mg/mL) 一次用小瓶。
贮存和稳定性:冰箱在2 ºC至8ºC(36°F至46°F),不要冻结。不要摇晃。用前通过贮存在原始包装避光保护小瓶。
17 患者咨询资料
见FDA批准的患者说明书(患者资料).
超敏性/过敏反应
告知患者用CINQAIR给药曽发生超敏性反应,包括过敏反应。教育患者超敏性反应和过敏反应的体征和症状(如,皮肤或粘膜涉及,气道损伤,血压减低)。指导患者如他们曽接受他们的CINQAIR输注后他们经受过敏反应症状立即联系他们的卫生保健专业人员[见警告和注意事项(5.1)]。
不是为急性症状或恶化疾病
告知患者CINQAIR不治疗急性哮喘症状或急性加重。
告知患者用CINQAIR治疗开始后如他们的哮喘仍未控制或恶化寻求医疗建议[见警告和注意事项(5.2)]。
恶性病
与CINQAIR-治疗患者商讨关于恶性病的风险[见警告和注意事项(5.3)]。
皮质激素剂量的减低
告知患者除了在医生的直接监督下不要终止全身或吸入皮质激素。告诉患者皮质激素剂量的减低可能伴随全身撤药症状和/或揭示以前全身皮质类固醇治疗抑制条件[见警告和注意事项(5.4)]。

