Erivedge(vismodegib)胶囊使用说明书2012年第一版
批准日期:J2012年1月30日;公司:Genentech
在监督管理局优先审评计划下评审Erivedge,是FDA-批准对转移基底细胞癌第一个药物。
FDA药物评价和研究中心血液学和肿瘤室主任Richard Pazdur, M.D.说“对涉及癌分子通路我们的了解,例如刺猬[Hedgehog[通路,已能发展靶向特异性疾病药物。”“这个方法正在成为更常用和将潜在允许更迅速发展癌药物。对患者得到更有效治疗与更少潜在副作用是重要的。”
处方资料:http://www.accessdata.fda.gov/drugsatfda_docs/label/2012/203388lbl.pdf
处方资料重点
这些重点不包括安全和有效使用ERIVEDGE所需所有资料。请参阅下文为ERIVEDGE的完整处方资料。
美国初始批准:2012年

适应证和用途
ERIVEDGE™ (vismodegib)胶囊是一种刺猬[hedgehog]通路抑制剂适用于手术后复发或不是手术备选者,和不是放疗备选者有转移基底细胞癌,或有局部晚期基底细胞癌成年的治疗。(1)
剂量和给药方法
推荐剂量是150 mg口服每天1次。(2)
剂型和规格
150 mg胶囊。 (3)
禁忌证
无。
警告和注意事项
(1)胚胎-胎儿死亡和严重出生缺陷:ERIVEDGE可能致胚胎-胎儿死亡或严重出生缺陷。(5.1)
(2)献血:建议患者当接受ERIVEDGE和末次ERIVEDGE剂量后至少7个月不要献血或血液产品。(5.2)
不良反应
最常见不良反应(发生率≥10%)是肌肉痉挛,脱发,味觉障碍,体重减轻,疲乏,恶心,腹泻,食欲减退,便秘,关节痛,呕吐,和完全丧失味觉。
为报告怀疑不良反应联系Genentech, Inc.电话1-888-835-2555或FDA电话1-800-FDA-1088或www.fda.gov/medwatch.
特殊人群中使用
(1)妊娠:可能引起胎儿危害。忠告生殖潜能女性对胎儿潜在风险。(5.1, 8.1)
(2)哺乳母亲:终止药物或哺乳考虑药物对母亲的重要性。(8.3)
(3)女性生殖潜能和男性:咨询男性和女性对预防妊娠和计划。.暴露于ERIVEDGE期间妊娠立即报告Genentech不良反应在线电话1-888-835-2555。鼓励患者通过在线电话1-888-835-2555联系Genentech不良反应参加ERIVEDGE妊娠药物监察计划。(8.6)
完整处方资料

1 适应证和用途
ERIVEDGE胶囊是适用于有转移基底细胞癌成年,或有局部晚期基底细胞癌手术后复发或不是手术备选者,和不是放疗备选者的治疗。
2 剂量和给药方法
ERIVEDGE的推荐剂量是50 mgn口服每天1次直至疾病进展或直至不可接受毒性[见临床研究(14)]。
ERIVEDGE可与或不与食物服用。整胶囊吞服。不要打开或压碎胶囊。
如漏服一剂ERIVEDGE,不要补服概剂量,按时间进度给予下一次剂量。
3 剂型和规格
ERIVEDGE(vismodegib)胶囊,150 mg。胶囊有粉红色不透明体和一个灰色不透明帽,胶囊上用墨水印有“150 mg”和胶囊帽上印有“VISMO”。
4 禁忌证
无。
5 警告和注意事项
5.1 胚胎-胎儿死亡和严重出生缺陷
ERIVEDGE胶囊可能引起胎儿危害当给予妊娠妇女根据其作用机制。在大鼠中Vismodegib是致畸胎性,胚胎毒性,和在母体的暴露低于人在推荐剂量150 mg/day暴露时有胎儿毒性。在大鼠中,畸形包括颅面畸形,会阴开放,和缺乏或指趾融合。还观察到胎儿延迟发育和变异。
开始ERIVEDGE前验证妊娠状态。忠告男性和女性患者胚胎-胎儿死亡和严重出生缺陷的风险和需要治疗期间和后避孕。忠告患者如(或,对男性,其女性伴侣)他们有怀疑可能怀孕时立即联系他们的卫生保健提供者。女性和男性患者的生殖潜能应被劝告关于妊娠预防和计划。如妊娠期间使用ERIVEDGE或如服药时患者成为妊娠而服用(或对一男性患者,如他的女性伴侣被暴露于)ERIVEDGE,患者应被告知对胎儿潜在危险。妊娠时暴露于ERIVEDGE立即报告Genentech不良事件线电话1-888-835-2555。鼓励妊娠时可能已被暴露于ERIVEDGE妇女,或直接或通过精液,参加ERIVEDGE妊娠药物监察程序通过联系Genentech不良事件线电话1-888-835-2555 [见黑框警告, 特殊人群中使用(8.1, 8.6)]。
5.2 献血
忠告患者当接受ERIVEDGE和末次剂量ERIVEDGE后至少7个月不要献血或血液制品。
6 不良反应
6.1 临床试验经验
因为临床试验是在广泛不同情况下进行的,临床试验观察到不良反应率不能与另一种药临床试验发生率直接比较而且可能不反映实践中观察到的发生率。
在四项开放,非对照,剂量-范围或固定单剂量临床试验,纳入共计138例晚期基底细胞癌(BCC)患者ERIVEDGE胶囊被给予单药治疗剂量 ≥ 150 mg口服每天。这些患者中位年龄为61岁(范围21至101),100% 是白种人(包括西班牙裔),和64%是男性。治疗的中位时间是约10个月(305天; 范围0.7 至36个月);111例患者接受ERIVEDGE共6个月或更长。
最常见不良反应(≥10%)是肌肉痉挛,脱发,味觉障碍,体重减轻,疲乏,恶心,腹泻,食欲减退,便秘,关节痛,呕吐,和完全丧失味觉(表1)。
无月经:
在临床试验中,当接受ERIVEDGE共计3/10例绝经前妇女发生无月经[见非临床毒理学(13.1)].
实验室异常:
在临床试验中观察到治疗-出现3级实验室异常是6例患者(4%)低钠血症,患者(1%)低钾血症,和3例患者(2%)氮质血症。
7 药物相互作用
7.1 其他药物对Vismodegib的影响
抑制或诱导药物代谢酶药物
Vismodegib消除涉及多种途径。Vismodegib主要以未变化药物被排泄。被多种CYP酶产生几种次要代谢物。尽管在体外vismodegib是CYP2C9和CYP3A4一种底物,CYP抑制作用预计不改变vismodegib的全身暴露因为在临床试验中用CYP3A4诱导剂(即,卡马西平[carbamazepine],莫达非尼[modafinil],苯巴比妥[Phenobarbital])患者同时治疗和用CYP3A4抑制剂(即,erythromycin, fluconazole)同时治疗患者观察到相似稳态血浆vismodegib浓度。
抑制药物转运系统药物
体外研究表明vismodegib是流出转运蛋白P-糖蛋白(P-gp)的底物。当ERIVEDGE与抑制P-gp药物(如克拉霉素[clarithromycin],红霉素[erythromycin],阿奇霉素[azithromycin])共同给药时,vismodegib的全身暴露和ERIVEDGE不良事件的发生率可能增加。
影响胃pH药物
改变上GI肠道的pH药物(如质子泵抑制剂,H2-受体拮抗剂,和抗酸药)可能改变vismodegib的溶解度和减低其生物利用度。但是,未进行正规临床研究评价胃pH改变药物对vismodegib的全身暴露的影响。当与这类药物共同给药时增加ERIVEDGE的剂量不太可能补偿暴露的减失。当ERIVEDGE与一种质子泵抑制剂,H2-受体拮抗剂或抗酸药共同给药时, vismodegib的全身暴露可能减低而对ERIVEDGE疗效的影响不知道。
7.2 Vismodegib对其他药物的影响
癌症患者中进行药物-药物相互作用研究结果显示罗格列酮[rosiglitazone]( CYP2C8底物)或口服避孕药(炔雌醇[ethinyl estradiol]和炔诺酮[norethindrone)]任何药物与vismodegib共同给药时全身暴露是无改变。
体外研究表明vismodegib是CYP2C8,CYP2C9,CYP2C19和转运蛋白BCRP的抑制剂。在人肝细胞中Vismodegib不诱导CYP1A2,CYP2B6,或CYP3A4/5。
8 特殊人群中使用
8.1 妊娠
妊娠类别D
当妊娠女性给予ERIVEDGE胶囊根据其作用机制可能引起胎儿危害。在大鼠中在剂量相当于推荐人用剂量时 (估算的AUC0-24hr稳态暴露)暴露的20%,Vismodegib是致畸胎性。在大鼠中,畸形包括颅面畸形,会阴开放,和缺乏或指趾融合。还观察到胎鼠延迟发育和变异。在大鼠中在暴露达到推荐人用剂量范围内Vismodegib是胚胎致死性。如妊娠时使用ERIVEDGE,或如患者服此药时成为妊娠,应忠告患者对胚胎或胎儿潜在危害。妊娠时暴露于ERIVEDGE立即报告Genentech不良事件线电话1-888-835-2555. 鼓励妇女,或直接或通过精液,妊娠时可能已被暴露于ERIVEDGE, 参加ERIVEDGE妊娠药物监察程序通过联系Genentech不良事件线电话1-888-835-2555 [见黑框警告, 警告和注意事项(5.1)]。
在一项胚胎-胎儿发育毒性研究,在器官生成阶段期间妊娠大鼠经口给予vismodegib剂量10,60,或300 mg/kg/day。在剂量 ≥ 60 mg/kg/day(在推荐人用剂量患者时全身暴露(AUC)约≥ 2倍时),植入前-和后-丢失增加其中包括早期100%胎儿再吸收。剂量10 mg/kg/day(患者推荐剂量AUC的约0.2倍)导致畸形(包括缺失和/或指趾融合,会阴开放和颅面畸形)和延迟或变异(包括肾盂扩张, 输尿管扩张,和完全地或未骨化的胸骨要素, 脊椎骨中央,或近端指骨和爪)。
8.3 哺乳母亲
不知道vismodegib是否排泄在人乳汁。因为许多药物被拍戏在人乳和因为哺乳婴儿来自ERIVEDGE严重不良反应潜能,应作出决策是否终止哺乳或终止药物,考虑药物对母亲的重要性。
8.4 儿童使用
未曾在儿童患者中确定Erivedge胶囊的安全性和有效性。
在大鼠中重复给药毒理学研究,经口给予vismodegib导致骨和齿中毒性。当经口给予vismodegib共26周在 ≥ 50 mg/kg/day(患者在推荐人用剂量时全身暴露(AUC)的约≥ 0.4倍)对骨影响包括骨骺生长板闭合。经口给予vismodegib在≥ 15 mg/kg/day(患者在推荐人用剂量时AUC的约≥ 0.2倍)观察到门牙生长异常(包括成牙本质细胞[odontoblasts]变性/坏死,牙髓中形成充满液体的囊肿, 根管的骨化,和出血导致牙齿破损或丢失)。
8.5 老年人使用
ERIVEDGE胶囊临床研究不包括足够数量65岁和以上患者确定他们的反应是否与较年轻患者不同。
8.6 生殖潜力妇女和男性
妊娠时给予ERIVEDGE胶囊可引起对胚胎或胎儿危害。规劝女性和男性患者有关娠预防和计划。忠告患者乳怀疑她们(或,对男性其女性伴侣)可能怀孕立即联系卫生保健提供者[见黑框警告, 警告和注意事项(5.1), 特殊人群中使用(8.1)]。
女性患者
有生育能力女性在开始治疗前7天内确定妊娠状态。妊娠试验阴性女性,首次剂量前开始用高效形式避孕(失败率小于1%)。治疗期间继续高效避孕末次ERIVEDGE剂量后共7个月。当服用ERIVEDGE时或末次剂量后7个月期间如患者成为妊娠,报告该妊娠至Genentech不良事件线电话1-888-835-2555,鼓励妊娠女性参加ERIVEDGE妊娠药物监察程序通过电话Genentech不良事件线电话1-888-835-2555。忠告妊娠女性关于对胎儿致畸胎性风险。
在临床试验中有生育能力女性中观察到无月经。不知道无月经的可逆性[见不良反应(6), 非临床毒理学(13.1)]。
男性患者
男性患者在与女性伴侣性交时而正在用ERIVEDGE胶囊治疗和末次剂量2个月后应使用避孕套和杀精子药,即使输精管切除术后, 为避免胚胎或胎儿暴露于vismodegib。
8.7 肝受损
尚未确定Erivedge胶囊在肝受损患者中的安全性和有效性[见临床药理学(12.3)]。
8.8 肾受损
尚未确定Erivedge胶囊在肾受损患者中的安全性和有效性[见临床药理学(12.3)]。
10 药物过量
在人中无药物过量资料。在临床试验中,ERIVEDGE胶囊是给予540 mg口服每天1次;每天150 mg和540 mg间暴露不增加。
11 一般描述
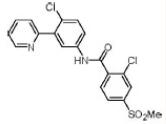
Vismodegib是一种刺猬[hedgehog, Hh]信号通路的抑制剂, 化学上被描述为2-Chloro-N-(4-chloro-3-(pyridin-2-yl)phenyl)-4-(methylsulfonyl)benzamide。分子式C19H14Cl2N2O3S。分子量421.30 g/mol和结构式为:
Vismodegib是一种结晶游离碱有pKa(吡啶阳离子)3.8,表现为白色至黄褐色粉。Vismodegib溶解度是pH依赖性在pH 7时为0.1 μg/mL和在pH 1时为0.99 mg/mL。分配系数(log P)为2.7。
每粒ERIVEDGE(vismodegib)为口服给药胶囊含150 mg vismodegib和下列无活性成分微晶纤维素,乳糖一水合物,十二烷基硫酸钠,碘伏,淀粉乙醇酸钠,滑石粉,和硬脂酸镁(非-牛)。胶囊壳含明胶,二氧化钛,红氧化铁,和黑氧化铁。黑色印墨水含虫胶和黑氧化铁。
12 临床药理学
12.1 作用机制
Vismodegib是一种刺猬[Hedgehog]通路的一种抑制剂。Vismodegib结合至和抑制Smoothened,涉及刺猬[Hedgehog]信号传导中的一种穿膜蛋白。
12.3 药代动力学
吸收
Vismodegib是一种高度通透性有低水溶解度化合物(BCS类别2)。Vismodegib的单次给药绝对生物利用度是31.8%。吸收是饱和的因在单次给药270 mg或540 mg vismodegib后缺乏剂量正比例性的证据。服用ERIVEDGE胶囊可不考虑进餐因为在稳态时vismodegib的全身暴露不受食物影响。
分布
Vismodegib的分布容积范围从16.4至26.6 L。在患者中Vismodegib血浆蛋白结合大于99%。Vismodegib结合至人血清白蛋白和α-1-酸性糖蛋白(AAG)和结合至AAG是饱和的。
代谢
大于98%的总循环药物-相关成分是母药。在人中vismodegib的代谢通路包括氧化,葡萄糖醛酸结合,和吡啶环裂解。在粪中回收的两个最丰富氧化代谢物是在体外重组CYP2C9和CYP3A4/5产生的。
消除
Vismodegib及其代谢物主要通过肝途径消除,在粪中回收给药剂量的82%和尿中回收4.4%。在连续每天1次给予Vismodegib后,估算的消除半衰期(t1/2)为4天和单次给药后为12天。
在特殊人群中药代动力学
肝受损:尚未研究肝受损对vismodegib全身暴露的影响。
肾受损:尚未研究肾受损对vismodegib全身暴露的影响。
群体药代动力学分析显示体重(范围:41-140 kg),年龄(范围:26-89岁),肌酐清除率(范围:30至80 mL/min),和性别对vismodegib的全身暴露没有临床上意义的影响。
12.6 心脏电生理学
在60例健康受试者中的一项彻底的QTc研究,治疗剂量的ERIVEDGE对QTc间隔没有影响。
13 非临床毒理学
13.1 癌发生,突变发生,生育能力受损
尚未用vismodegib进行致癌性研究。在大鼠中经口给予vismodegib 在100 mg/kg/day共26周(患者推荐人用剂量时全身暴露(AUC)约0.8倍)观察到毛母质瘤[Pilomatricoma](一种良性皮新生物).
在体外细菌回复突变(Ames)试验中Vismodegib不是致突变剂和在体外人外周血淋巴细胞人染色体畸变试验或在体内大鼠骨髓细胞微核试验中不是染色体断裂剂。
未曾进行研究评估vismodegib影响生育能力的潜能;但是,从在大鼠和犬中重复-给药毒理学研究资料表明在患者接受ERIVEDGE胶囊男性和女性生殖功能和生育能力可能受损。在大鼠中一项26-周毒理学研究,观察到在 ≥ 15 mg/kg/day(约≥0.3 times the AUC in患者在推荐人用剂量时)活动精子百分率相对减低。在犬中,在年幼动物中经口给予vismodegib共4周在 ≥ 50 mg/kg/day(患者在推荐人用剂量时AUC的约≥2倍)观察到退化的生殖细胞数目增加和精子减少症。在13-周和26-周毒理学研究在性成熟犬中在相似剂量未观察到相应发现。在雌性大鼠中经口给予vismodegib共26周在100 mg/kg/day(患者在推荐人用剂量时AUC约0.8倍)观察到黄体数减少。
13.2 动物毒理学
神经学效应特征为在大鼠中口服给予vismodegib共4周或更长在 ≥ 50 mg/kg/day (AUC约为患者推荐人用剂量时≥ 0.4倍)观察到肢或体震颤或抽搐。终止给药这些观察解决和不伴有显微镜下发现。
14 临床研究
在104例有或转移基底细胞癌(mBCC)(n = 33)或局部晚期BCC(laBCC)(n = 71)患者中进行一项单个,国际,单组,多中心,开放,2-队列试验。laBCC患者被要求有放疗后复发病变,除非放疗被禁忌或不适宜(如Gorlin 综合征;因为肿瘤位置或既往放疗累积剂量限制),和其病变是或不能手术切除或手术切除会导致实质上畸形。患者接受150 mg vismodegib每天口服直至疾病进展或不可接受毒性。
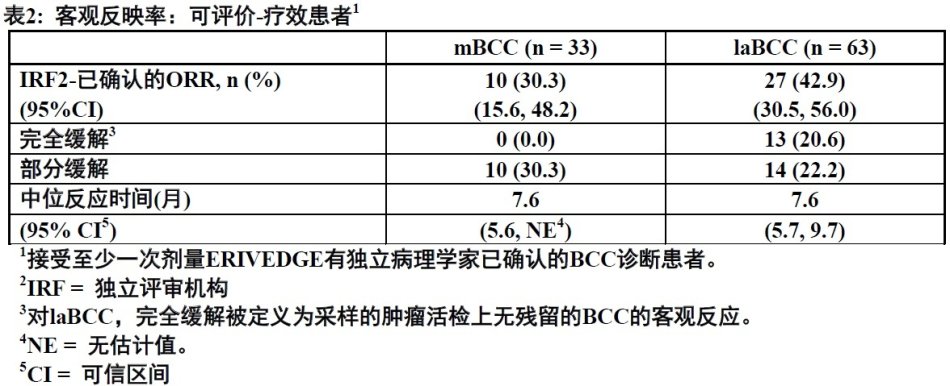
试验主要有效性结局测量是由一个独立评审机构(IRF)评估的客观反应率(ORR)。在mBCC队列中,按照实体瘤疗效评价标准(RECIST)版本1.0评估肿瘤反应。在laBCC队列中,肿瘤反应评价包括外部可评估肿瘤的测量(包括瘢痕)和照片中溃疡的评估,目标病变的放射影像学评估(如合适),和肿瘤活检。在laBCC 客观反应要求至少下列标准之一和缺乏对疾病进展任何标准:(1) 病变大小[最长直径(SLD)之和]目标病变用放射影像学评估从基线减小≥ 30%;(2)外部可见性目标病变尺寸SLD从基线缩小≥ 30%; (3)所有目标病变中溃疡完全解决。完全缓解被定义为客观反应(如上所述)无残留的BCC采样的肿瘤活检上. 疾病进展被定义为下面任何一种:(1)目标病变SLD从最低值增加≥ 20%(或放射学或外部可见尺寸);(2)目标病变持续的新溃疡无愈合证据至少2周;(3)放射影像学评估或体检新病变; (4)按RECIST非-目标病变进展。
纳入104例患者中,96例患者被评价ORR。21%患者有Gorlin综合征诊断。可评价疗效人群中位年龄为62 岁(46%是至少65岁),61%男性和100%白种人。对mBCC队列(n = 33),97%患者有既往治疗包括手术(97%),放疗(58%),和全身治疗(30%)。对laBCC队列(n = 63),94%患者有既往治疗包括手术(89%),放疗(27%),和全身/局部治疗(11%)。治疗的中位时间为10.2个月(范围0.7至18.7个月)。
在表2中,下面展示关键结局测量

16 如何供应/贮存和处置
每个ERIVEDGE(vismodegib)胶囊有粉红色不透明体和灰色不透明帽黑色墨水将“150 mg”印在胶囊体上和“VISMO” 印在胶囊帽上。在28胶囊瓶装可得到ERIVEDGE胶囊(NDC 50242-140-01)。
贮存在室温20°C至25°C(68°F至77°F);外出允许15°C至30°C(59°F至86°F)间[见USP控制室温]。
17 患者咨询资料
见FDA-批准的患者说明书(用药指南)。
忠告患者妊娠期间ERIVEDGE暴露可致胚胎-胎儿死亡或严重出生缺陷。
指导女性患者的生殖潜能当服用ERIVEDGE时使用一种高效避孕形式(失败率小于1%)和末次ERIVEDGE后至少7个月。
指导所有男性患者,当服用ERIVEDGE时,和末次剂量ERIVEDGE后至少2个月,当与女性伴侣性交时,使用避孕套与杀精药,即使输精管切除术前。
指导患者暴露于ERIVEDGE后如她们(或,对男性,他们的女伴侣)成为怀孕或如怀疑妊娠时立即联系其卫生保健提供者。
指导暴露于ERIVEDGE患者立即报告任何妊娠和鼓励参加ERIVEDGE妊娠药物监察计划通过与Genentech不良事件线1-888-835-2555打电话联系。
告知女性患者哺乳婴儿来自ERIVEDGE严重不良反应潜能,考虑到药物对母亲的重要性。
忠告患者当服用ERIVEDGE和末次ERIVEDGE后至少7个月不要献血或血液制品。
忠告患者整个吞服ERIVEDGE胶囊和不要压碎或打开胶囊。

